
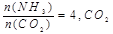 ��ת������ʱ��ı仯��ϵ��ͼ1��ʾ��
��ת������ʱ��ı仯��ϵ��ͼ1��ʾ��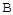 ������ΪV����CO2��������ڡ�����С�ڡ����ڡ���
������ΪV����CO2��������ڡ�����С�ڡ����ڡ���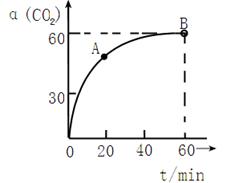
 CO(NH2)2+H2O �� 30%
CO(NH2)2+H2O �� 30% CO(NH2)2+H2O��
CO(NH2)2+H2O��

 ����5��2���ϵ�д�
����5��2���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ��� | ʵ������ | ʵ��Ŀ�� |
| A | ȡ��ֻ�Թܣ��ֱ����4ml 0.01mol/L KMnO4������Һ��Ȼ����һֻ�Թ��м���0.1mol/L H2C2O4��Һ2ml������һֻ�Թ��м���0.1mol/L H2C2O4��Һ4ml����¼��ɫʱ�䡣 | ����֤��H2C2O4Ũ��Խ��Ӧ����Խ�졣 |
| B | ��1ml 0.2mol/L NaOH��Һ�е���2��0.1mol/L MgCl2��Һ��������ɫ�������ٵμ�2��0.1mol/L FeCl3��Һ�������ɺ��ɫ������ | ����֤������ͬ�¶��£��ܽ��Mg(OH)2��Fe(OH)3 |
| C | �ⶨ�����ʵ���Ũ�ȵ�Na2SO3��Na2CO3��Һ��pH�����߽ϴ� | ֤���˷ǽ�����S��C |
| D | ���з�̪��Na2CO3��Һ�м�������BaCl2���壬��Һ��ɫ���dz�� | ����֤��Na2CO3��Һ�д���ˮ��ƽ�⡣ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH��g�� ��H
CH3OH��g�� ��H

| A��2v(H2)(��) =v(CO)(��) |
| B�����������ܶȲ��� |
| C����������ƽ����Է����������� |
| D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A����100 �桢101 kPa�����£�Һ̬ˮ��������Ϊ40.69 kJ��mol-1����H2O(g) H2O(l) �Ħ�H =" 40.69" kJ��mol-1 H2O(l) �Ħ�H =" 40.69" kJ��mol-1 |
| B����֪MgCO3��Ksp =" 6.82" �� 10-6�������к��й���MgCO3����Һ�У�����c(Mg2+) = c(CO32-)����c(Mg2+) �� c(CO32-) =" 6.82" �� 10-6 |
C����֪��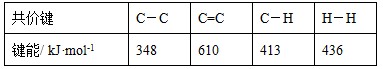 ����Լ������Ӧ  �Ħ�HΪ��384 kJ��mol-1 �Ħ�HΪ��384 kJ��mol-1 |
| D�������£���0.10 mol��L-1��NH3��H2O��Һ�м�������NH4Cl���壬��ʹNH3��H2O�ĵ���Ƚ��ͣ���Һ��pH��С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ʵ����У���Ӧ���ɵ�Mn2+�����Ǹ÷�Ӧ�Ĵ��� |
| B��ʵ����У��÷�Ӧ��̫����ת��Ϊ���� |
| C��ʵ����У������ݲ����İ������� |
| D��ʵ����У������ˮ�Ƿ�Ӧ�Ĵ������Ҹ÷�Ӧ���Է����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
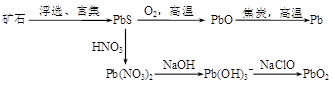
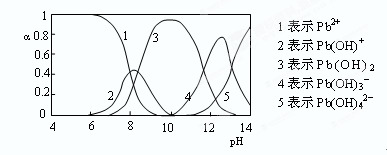
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
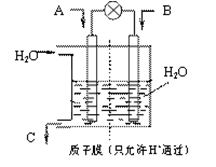
 N2O4(g) ��H <0��ƽ�ⳣ�� K��13.3������������ܱ�������N2O4��NO2�Ļ������ﵽƽ��ʱ���� c (NO2) =" 0.0300" mol��L��1��
N2O4(g) ��H <0��ƽ�ⳣ�� K��13.3������������ܱ�������N2O4��NO2�Ļ������ﵽƽ��ʱ���� c (NO2) =" 0.0300" mol��L��1���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2OH?+H2��+Cl2��
2OH?+H2��+Cl2��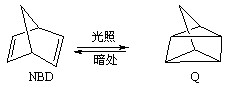 �����ø÷�Ӧ��������̫���ܣ���NBD�����ܱ�Q�����ܸ�
�����ø÷�Ӧ��������̫���ܣ���NBD�����ܱ�Q�����ܸ�| ��ѧ�� | N��N | H?O | N?H | O=O |
| ����/kJ��mol-1 | 945 | 463 | 391 | 498 |
 2NH3(g)+ 3/2O2(g)����H=+630kJ��mol-1
2NH3(g)+ 3/2O2(g)����H=+630kJ��mol-1�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CO2+NO ��H =" a" kJ/mol�ﵽƽ������¶ȣ�����������ɫ��dz�������ж���ȷ����
CO2+NO ��H =" a" kJ/mol�ﵽƽ������¶ȣ�����������ɫ��dz�������ж���ȷ����| A��a<0 |
| B�������¶ȣ������ʵ�Ũ�Ȳ��� |
| C�������¶ȣ�CO��ƽ��ת���ʽ��� |
| D��ʹ�ô����ܼӿ췴Ӧ���ʲ���߷�Ӧ���ƽ��ת���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com