
实验用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历下列过程,
Fe3+在pH=5时已完全沉淀,其中分析错误的是
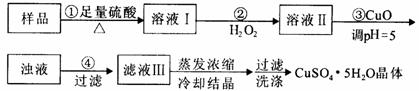
A.利用CuCO3替代CuO也可调节溶液的pH,不影响实验结果
B.步骤②中发生的主要反应为:H2O2+Fe2++2H+=F e3++2H2O
e3++2H2O
C.洗涤晶体:向滤出晶体的漏斗中加少量水至浸没晶体,待自然流下后,重复2~3次
D.配制240 mL1mol/L的CuSO4溶液,需称量CuSO4·5H2O的质量为62.5g
科目:高中化学 来源: 题型:
某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成如下实验:
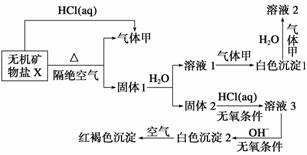
另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。
请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图______,写出气体甲的电子式______________。
(2)X的化学式是________,在惰性气流中加热X至完全分解的化学反应方程式为________________________________________________________________________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是__________________________________(用化学反应方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
用含1.0 mol NaOH的溶液吸收0.8 mol CO2,所得溶液中的CO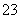 和HCO
和HCO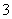 的物质的量之比为( )
的物质的量之比为( )
A.1∶3 B.2∶1
C.2∶3 D.3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.含有0.1 mol·L-1 Fe3+的溶液中:K+、Mg2+、SCN-、SO42-
B.c(H+)/c(OH-)= 1×1014的溶液: Ca2+、Na+、ClO-、NO3-
C.能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl-
D.水电离产生的c(H+) =10—12mol·L—1的溶液中:Na+、Fe2+、SO42—、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关离子方程式与所述事实相符且正确的是
A. 用惰性电极电解CuCl2溶液:2Cu2++2H2O 4H++O2↑+2Cu
4H++O2↑+2Cu
B.Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO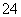 = BaSO4↓+H2O
= BaSO4↓+H2O
C.用双氧水和稀硫酸处理印刷电路板:Cu + H2O2 + 2H+ = Cu2+ + 2H2O
D.氯气和水的反应:Cl2+H2O=2H++Cl-+ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
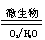 煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为________和________。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种
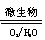 脱硫技术的原理为FeS2 Fe2++SO42—
脱硫技术的原理为FeS2 Fe2++SO42—
Fe3+这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为_____________________________,
第二步反应的离子方程式为____________________。
(3)工业煤干馏得到的产品有焦炭、________。
(4 )工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=________,实际生产要将r值维持在1.7~2.2之间,原因是________________________________________。
)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=________,实际生产要将r值维持在1.7~2.2之间,原因是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌的流程如下:
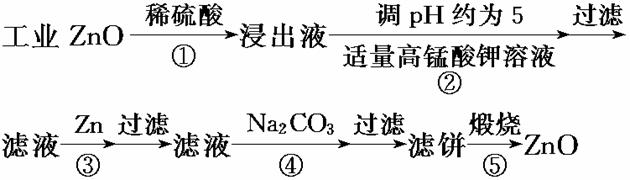
提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
回答下列问题:
(1)反应②中除掉的杂质离子是__________,发生反应的离子方程式为_________
_ ;在加高锰酸钾溶液前,若pH较低,对除杂的影响是________________。
(2)反应③的反应类型为____________,过滤得到的滤渣中,除了过量的锌外还有__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
含金属元素的离子一定都是阳离子
在氧化还原反应中,非金属单质一定是氧化剂
C. 某元素从游离态变为化合态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com