
|
R的气态氢化物为H2R,则R元素最高价氧化物的水化物的分子式可能是 | |
| [ ] | |
A. |
H4RO4 |
B. |
H3RO4 |
C. |
H2RO4 |
D. |
H2RO3 |
科目:高中化学 来源: 题型:阅读理解
| 元素 | 相关信息 |
| X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y | 地壳中含量最高的元素 |
| Z | 存在质量数为23,中子数为11的核素 |
| W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
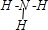
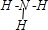
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | T | X | Y | Z | W |
| 元素的性质或原子结构情况 | 短周期主族元素中原子半径最大 | 最外层上的电子数比次外层少1个且单质是气体 | 核外共有13种运动状态不同的电子 | 若低温蒸发液态空气,因其沸点较低可先获得它的单质 | 核外有5种不同能量的电子且其中有两个未成对的电子 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| J | ||||
| M | R |

| 选项 | a | b | c | d |
| x | 温度 | 加入H2的物质的量 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| W | X | Y | ||
| R | Z |
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省高三第一次调研考试化学试卷(解析版) 题型:选择题
下表为周期表的一部分,有关短周期X、Y、Z、R四种元素叙述正确的是:

A.热稳定性:Y的气态氢化物<Z的气态氢化物
B.X的最高价氧化物对应水化物的酸性比Y的强
C.X元素的单质能与所有强酸发生反应放出H2
D.R元素的单质化学性质活泼
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com