

| 锂 | X | |
| 失去第一个电子(I1) | 519 | 580 |
| 失去第二个电子(I2) | 7296 | 1820 |
| 失去第三个电子(I3) | 11799 | 2750 |
| 失去第四个电子(I4) | 11600 |
分析 由元素在周期表中位置可知,①为H、②为N、③为Na、④为Al、⑤为P、⑥为Cl、⑦为Ar、⑧为K、⑨为Cr、⑩为Fe.
(1)某元素原子的核外所有p电子数比s电子总数少1,原子核外电子排布为1s22s2p3;
(2)元素⑨为Cr,原子核外有24个电子,的基态原子的外围电子排布式是3d54s1;
(3)元素⑩在周期表中的位置是第四周期第Ⅷ族,属于d区;
(4)非金属性越强,对应氢化物的还原性越弱;
(5)由表中数据可知,X的第四电离能剧增,故Y表现+3价,最外层电子数为3,应为ⅢA族元素,应为上述元素中的Al;
锂原子核外共有3个电子,其中两个在K层,1个在L层,当失去最外层的一个电子后,锂离子处于稳定结构.
解答 解:由元素在周期表中位置可知,①为H、②为N、③为Na、④为Al、⑤为P、⑥为Cl、⑦为Ar、⑧为K、⑨为Cr、⑩为Fe.
(1)某元素原子的核外所有p电子数比s电子总数少1,原子核外电子排布为1s22s2p3,为N元素,故答案为:N;
(2)元素⑨为Cr,原子核外有24个电子,的基态原子的外围电子排布式是3d54s1,最高正化合价为+6,故答案为:3d54s1;+6;
(3)元素⑩在周期表中的位置是第四周期第Ⅷ族,属于d区,故答案为:Ⅷ;d;
(4)非金属性Cl>P,非金属性越强,对应氢化物的还原性越弱,故答案为:弱;
(5)由表中数据可知,X的第四电离能剧增,故Y表现+3价,最外层电子数为3,应为ⅢA族元素,应为上述元素中的Al;
锂原子核外共有3个电子,其中两个在K层,1个在L层,当失去最外层的一个电子后,锂离子处于稳定结构,根据题给信息可知,要使锂离子再失去电子便会形成不稳定结构,因此锂原子失去第二个电子时所需能量远大于失去第一个电子所需的能量,
故答案为:铝;Li原子失去1个电子后形成全充满的稳定结构,能量较低,难于再失去第二个电子.
点评 本题考查位置结构性质的相互关系及应用,题目难度不大,注意掌握元素周期律,注意电离能的大小与核外电子排布的关系.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题



 .
. (其中一种).
(其中一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 一氧化碳和氢气反应可生成甲醛:CO(g)+H2(g)?HCHO(g)△H<0,一定温度下,向恒容密闭容器中充入等物质的量的H2、CO和HCHO三种气体,测得CO的净反应速率(即正反应速率减去逆反应速率)随时间的变化曲线如图所示,其中第5min和第7min时分别改变了反应的一个条件,下列说法正确的是( )
一氧化碳和氢气反应可生成甲醛:CO(g)+H2(g)?HCHO(g)△H<0,一定温度下,向恒容密闭容器中充入等物质的量的H2、CO和HCHO三种气体,测得CO的净反应速率(即正反应速率减去逆反应速率)随时间的变化曲线如图所示,其中第5min和第7min时分别改变了反应的一个条件,下列说法正确的是( )| A. | 前4 min阴影部分的值为CO的物质的量浓度的变化量 | |
| B. | 前4 min反应向正方向进行 | |
| C. | 第5 min时改变的条件可能为向容器中再分别充入1 mol H2、1 mol CO和1 mol HCHO | |
| D. | 第7 min时改变的条件可能为降低反应温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解后,c(Na2SO4)不变,且溶液中有晶体析出 | |
| B. | 电解池的阳极反应式为:4OH--4e-═2H2O+O2↑ | |
| C. | 蓄电池放电时,每消耗0.1molPb,共生成0.1molPbSO4 | |
| D. | 蓄电池中每生成2molH2O,电解池中就消耗1molH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | R | W | X | Y | Z |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
| A. | 离子还原性:Y2-<Z- | B. | 离子半径W+>Z- | ||
| C. | 气态氢化物稳定性:RH4<XH4 | D. | 酸性:H2YO4<HZO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.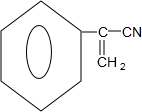 ,E中含氧官能团的名称为羧基.
,E中含氧官能团的名称为羧基. .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com