
分析 (1)根据题意,CF3SO3H是魔酸,能够将质子给予σ键,在CH3CH3中,存在两种类型的σ键:C-C键和C-H键,因此可能生成两种类型的二电子三中心键;
(2)以上生成的两种物质均属于缺电子的物质,因此发生分解反应,中间产物为存在碳正离子,如CH3+,CH3CH2+,它们都能与CF3SO3-结合生成取代磺酸.CH3CH2+还能发生消去反应,生成烯烃--CH2=CH2.
解答 解:(1)根据题意,CF3SO3H是魔酸,能够将质子给予σ键,在CH3CH3中,存在两种类型的σ键:C-C键和C-H键,因此可能生成两种类型的二电子三中心键,即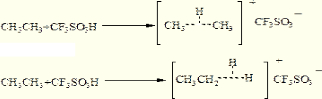 ,
,
答:CH3CH3与CF3SO3H可能的反应式为 ;
;
(2)以上生成的两种物质均属于缺电子的物质,因此发生分解反应,中间产物为存在碳正离子,如CH3+,CH3CH2+,它们都能与CF3SO3-结合生成取代磺酸.CH3CH2+还能发生消去反应,生成烯烃--CH2=CH2.反应的方程式为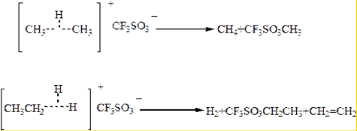 ,
,
答:分解以后所得到的全部可能产物为CH2=CH2、CH4、CF3SO3CH3、H2.
点评 本题考查物质的结构和性质,为高频考点,侧重于学生的分析能力的考查,本题为信息给予题,难度较大,注意把握物质的性质以及题给信息.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
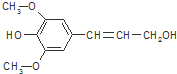
| A. | 芥子醇的分子式为C11H14O4,属于芳香族化合物 | |
| B. | 芥子醇分子中含9种不同化学环境的H原子 | |
| C. | 芥子醇分子中所有碳原子可能在同一平面上 | |
| D. | 1mol芥子醇能与足量溴水反应消耗3molBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | 加入试剂 | 实验现象 |
| Ⅰ | 2滴 0.1mol/L FeCl3 溶液 | ①白色沉淀转化为红褐色沉淀 |
| Ⅱ | 4mL2mol/LNH4Cl溶液 | ②白色沉淀溶解,得无色溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸和过量的铁屑反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| B. | 碳酸钠溶液水解的离子方程式:CO32-+2H2O?H2CO3+2OH- | |
| C. | 氢气的燃烧热为285.8 kJ/mol,则表示氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ/mol | |
| D. | 浓盐酸与MnO2共热制氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 某物质做焰色反应时,火焰呈黄色,则该物质中肯定不存在钾元素 | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯(苯酚):氢氧化钠,蒸馏 | B. | 乙酸丁酯(乙酸):碳酸钠,分液 | ||
| C. | 乙醇(苯酚):氢氧化钠,分液 | D. | 乙醇(乙酸):碱石灰,分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com