
分析 (1)有两种盐,它们均由位于元素周期表前两周期相同的四种元素组成,且它们既可以和强酸反应,又可以和强碱反应,形成的盐可以是碳酸氢铵和碳酸氨;
(2)胶体微粒是氢氧化铝的集合体,微粒直径在1nm-100nm间,1mol KAl(SO4)2含有1molAl3+,2molSO42-,开始发生反应SO42-+Ba2+=BaSO4↓,Al3++3OH-=A1(OH)3↓,Al3+完全沉淀,再继续滴加Ba(OH)2溶液,发生反应A1(OH)3+OH-=A1O2-+2H2O,SO42-+Ba2+=BaSO4↓,判断Al3+完全沉淀后再滴加Ba(OH)2溶液沉淀量的物质的量变化,确定沉淀量最大时发生的反应,注意此时钡离子与氢氧根离子为1:2;
(3)高锰酸钾能氧化盐酸稀硝酸具有强氧化性;
(4)根据向一定量的Na2CO3溶液中缓慢地滴加稀盐酸,则先后发生Na2CO3+HCl═NaCl+NaHCO3、NaHCO3+HCl═NaCl+CO2↑+H2O,则Na+数目不发生变化,氯离子的数目在增加,碳酸根离子的数目一直在减少,直到为0,碳酸氢根离子的数目先增大后减小,直到为0,据此分析对应的离子.
解答 解:(1)有两种盐,它们均由位于元素周期表前两周期相同的四种元素组成,且它们既可以和强酸反应,又可以和强碱反应,形成的盐可以是碳酸氢铵和碳酸氨,
故答案为:NH4HCO3;(NH4)2CO3;
(2)KAl(SO4)2是一种复盐,假设1molKAl(SO4)2完全转化为Al(OH)3胶体,氢氧化铝胶体微粒是氢氧化铝的集合体,则分散系中胶体微粒数小于1mol,
即微粒数小于NA,胶体的微粒直径大小介于1nm-100nm,
1mol KAl(SO4)2含有1molAl3+、2molSO42-,
开始发生反应SO42-+Ba2+=BaSO4↓,Al3++3OH-=A1(OH)3↓,
由方程式可知当加入1.5molBa(OH)2时,Al3+完全沉淀,SO42-反应1.5mol,SO42-有剩余,再继续滴加Ba(OH)2溶液,
发生反应A1(OH)3+OH-=A1O2-+2H2O,SO42-+Ba2+=BaSO4,
由方程式可知加入1molBa(OH)2,溶解2molA1(OH)3,生成1molBaSO4,
沉淀的物质的量减少,故当Al3+恰好沉淀时,生成的沉淀的物质的量最大,此时加入1.5molBa(OH)2,溶液体积V=$\frac{1.5mol}{1mol/L}$=1.5L,
故答案为:小于;1-100;1.5;
(3)KMnO4是一种常用的氧化剂,在酸性的条件下氧化能力更强,酸化时一般用稀硫酸,而不用盐酸,其原因是氯离子具有还原性,易被高锰酸钾溶液氧化,反应的离子方程式为:2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O,稀硝酸也具有氧化性,一般用硫酸酸化,
故答案为:2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O;稀硝酸也具有氧化性;
(4)向一定量的Na2CO3溶液中缓慢地滴加稀盐酸,则先后发生Na2CO3+HCl═NaCl+NaHCO3、NaHCO3+HCl═NaCl+CO2↑+H2O,
则Na+的数目不变,即图中a为Na+离子,
碳酸根离子在减少,直至为0,即图中b为CO32-离子,
碳酸氢根离子先增大后减小,直至为0,即图中c为HCO3-离子,
氯离子先为0,随盐酸的加入氯离子的数目在增多,
故答案为:Na+;CO32-;Cl-;HCO3-.
点评 本题考查物质反应过程中定量关系的分析判断、常见氧化还原反应中、碳酸钠与盐酸的反应来分析溶液中离子的变化,明确离子反应的实质、离子性质、离子反应的定量关系和产物判断是解答的关键,题目难度中等.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | ③④⑦ | B. | ③④⑤⑥⑦ | C. | ②③④⑦ | D. | ①③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
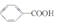 )和石灰的混合物得到一种液体,命名为苯.写出苯甲酸钠(
)和石灰的混合物得到一种液体,命名为苯.写出苯甲酸钠(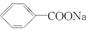 )与NaOH、生石灰共热生成苯的化学方程式:
)与NaOH、生石灰共热生成苯的化学方程式: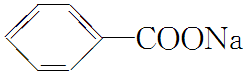 +NaOH
+NaOH  +Na2CO3.
+Na2CO3.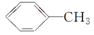 来制取
来制取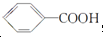 需要的试剂是KMnO4酸性溶液,下列物质属于苯的同系物且能被该试剂氧化的是d.
需要的试剂是KMnO4酸性溶液,下列物质属于苯的同系物且能被该试剂氧化的是d.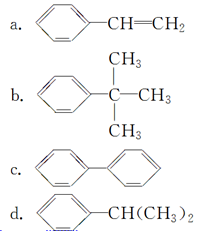
 .
. )脱去2mol氢原子变成苯却要放热,可推断苯比1,3-环己二烯稳定(填“稳定”或“不稳定”).
)脱去2mol氢原子变成苯却要放热,可推断苯比1,3-环己二烯稳定(填“稳定”或“不稳定”).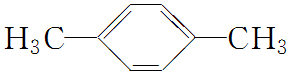 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
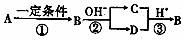 化合物A、B、C、D中均含有短周期元素X,B是一种常见的单质,它们有如图5所示的转化关系(部分产物与反应条件已略去),下列说法正确的是
化合物A、B、C、D中均含有短周期元素X,B是一种常见的单质,它们有如图5所示的转化关系(部分产物与反应条件已略去),下列说法正确的是| A. | X元素可能是金属,也可能是非金属 | |
| B. | 反应①、②、③均为氧化还原反应 | |
| C. | 反应②、③为可逆反应 | |
| D. | 若B为金属单质,反应①的“一定条件”为电解时,通常加入冰晶石作为助溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4NO3 | B. | NaOH | C. | MgSO4 | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(K+)+c(H+)═c(OH-)+c(HS-)+2 c(S2-) | B. | c(K+)>c(HS-)>c(OH-)>c(H+) | ||
| C. | c(HS-)+c(S2-)+c(H2S)=0.1 mol•L-1 | D. | c(K+)>c(HS-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | A | B |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| 反应能量变化 | 放出29.4KJ | 吸收aKJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com