
 在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,F在D中燃烧发出苍白色火焰.H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和部分反应条件未列出)
在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,F在D中燃烧发出苍白色火焰.H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和部分反应条件未列出)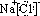 ,D为Cl2,Cl元素在周期表中的位置是第三周期ⅦA族,
,D为Cl2,Cl元素在周期表中的位置是第三周期ⅦA族, ;第三周期ⅦA族;
;第三周期ⅦA族; Si+2CO,若转移4mol电子参加反应的碳为2mol,
Si+2CO,若转移4mol电子参加反应的碳为2mol,

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
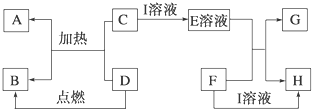 在如图所示的有关物质转化关系中,各物质均是我们中学化学所学的物质.C为一种黑色粉末,D为一种气体.请根据框图中物质的转化关系及相关信息,用化学式填写下列空白:
在如图所示的有关物质转化关系中,各物质均是我们中学化学所学的物质.C为一种黑色粉末,D为一种气体.请根据框图中物质的转化关系及相关信息,用化学式填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
 (2013?河东区二模)在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,F在D中燃烧发出苍白色火焰.H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和部分反应条件未列出)
(2013?河东区二模)在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,F在D中燃烧发出苍白色火焰.H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和部分反应条件未列出)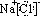
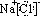
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
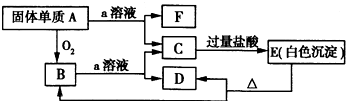 在如图所示的物质相互转化关系中,A是一种固体单质,E是一种白色不溶于水的物质.据此填空.
在如图所示的物质相互转化关系中,A是一种固体单质,E是一种白色不溶于水的物质.据此填空.查看答案和解析>>
科目:高中化学 来源:2013年天津市河东区高考化学二模试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com