
【题目】根据题意填空
(1)某温度下,纯水中的c(H+)=2.0×10﹣7mol/L,此时溶液的c(OH﹣)=mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10﹣4mol/L,则溶液中,由水电离产生的c(H+)=mol/L,此时温度25℃(填“高于”、“低于”或“等于”).
(2)某温度下的水溶液中,C (H+)=10x mol/L,C (OH﹣)=10y mol/L,x和y的关系如图所示.计算:该温度下水的离子积为 . 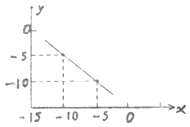
【答案】
(1)2.0×10﹣7;8×10﹣11;高于
(2)10﹣15
【解析】解:纯水显中性,即纯水中的c(H+)=c(OH﹣)=2.0×10﹣7mol/L,此温度下,水的离子积Kw=4.0×10﹣14;若温度不变,则水的离子积不变,滴入稀盐酸使c(H+)=5.0×10﹣4mol/L,则溶液中的c(OH﹣)= ![]() =
= ![]() =8×10﹣11mol/L,而在酸溶液中,所有的氢氧根全部来自于水的电离,而由水电离出的c(H+)=c(OH﹣),故由水电离出的c(H+)=8×10﹣11mol/L;25℃时,水的离子积Kw=1×10﹣14 , 而此温度下,水的离子积Kw=4.0×10﹣14 , 由于温度越高,水的电离被促进,水的离子积数值越大,故此温度高于25℃.所以答案是:2.0×10﹣7; 8×10﹣11;高于;(2)根据图知,当c(H+)=10﹣5 mol/L,c(OH﹣)=10﹣10 mol/L,由离子积常数=c(H+).c(OH﹣)=10﹣5.10﹣10=10﹣15 , 所以答案是:10﹣15 .
=8×10﹣11mol/L,而在酸溶液中,所有的氢氧根全部来自于水的电离,而由水电离出的c(H+)=c(OH﹣),故由水电离出的c(H+)=8×10﹣11mol/L;25℃时,水的离子积Kw=1×10﹣14 , 而此温度下,水的离子积Kw=4.0×10﹣14 , 由于温度越高,水的电离被促进,水的离子积数值越大,故此温度高于25℃.所以答案是:2.0×10﹣7; 8×10﹣11;高于;(2)根据图知,当c(H+)=10﹣5 mol/L,c(OH﹣)=10﹣10 mol/L,由离子积常数=c(H+).c(OH﹣)=10﹣5.10﹣10=10﹣15 , 所以答案是:10﹣15 .


科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.标准状况下,2.24L SO3中含有的SO3分子数为0.1NA
B.5.6 g Fe与标准状况下2.24L的Cl2充分反应,转移的电子数为0.3NA
C.将含3NA个离子的Na2O2固体溶于水配成1L溶液,所得溶液中Na+的浓度为2mol/L
D.1molMnO2与4mol浓盐酸充分反应后生成的Cl2分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制变量是科学研究的重要方法。相同质量的铁与足量稀硫酸分别在下列条件下发生反应,其中化学反应速率最大的是
选项 | 硫酸浓度 | 反应温度 | 铁的状态 |
A | 2.0 mol/L | 20℃ | 块状 |
B. | 0.5 mol/L | 20℃ | 粉末状 |
C. | 1.0 mol/L | 40℃ | 块状 |
D. | 2.0 mol/L | 40℃ | 粉末状 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代《天工开物》记载“火法”冶炼锌:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…冷淀,毁罐取出,…,即倭铅也”(注:炉甘石的主要成分为碳酸锌,泥罐中掺有煤炭).下列说法不正确的是( )
A.倭铅是指金属锌和铅的混合物
B.煤炭中起作用的主要成分是C
C.我国历史上铅的使用早于锌
D.该冶炼锌的方法属于热还原法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制0.1molL﹣1NaCl溶液,下列操作会导致所配溶液的物质的量浓度偏高的是( )
A.称量时,左盘低,右盘高
B.定容时俯视读取刻度
C.原容量瓶洗净后未干燥
D.定容时液面超过了刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铜、银和硝酸银构成的原电池工作时,正极为反应式______;当有1.6g铜溶解时,银棒增重________g。(原子量:Cu——64 Ag——108)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选取萃取剂将溴水中的溴萃取出来,这种萃取剂必须具备的性质是( )
A. 不溶于水,但必须与溴发生反应 B. 不溶于水,但比水更容易溶解溴
C. 不溶于水,且密度必须比水大 D. 不溶于水,且密度必须比水小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是.
A.![]() 的一溴代物和
的一溴代物和 ![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B.CH3CH=CHCH3分子中的四个碳原子在同一直线上
C.按系统命名法,化合物  的名称是2,3,4﹣三甲基﹣2﹣乙基戊烷
的名称是2,3,4﹣三甲基﹣2﹣乙基戊烷
D.![]() 与
与 ![]() 都是α﹣氨基酸且互为同系物
都是α﹣氨基酸且互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com