
 (g)△H=-106kJ•mol-1
(g)△H=-106kJ•mol-1 +AgO 快
+AgO 快| A. | 反应的活化能等于106kJ•mol-1 | |
| B. | AgO2也是反应的催化剂 | |
| C. | 增大乙烯浓度能显著提高环氧乙烷的生成速率 | |
| D. | 理论上0.7mol乙烯参与反应最多可得到0.6mol环氧乙烷 |
分析 A、反应热为:=-106kJ•mol-1;
B、氧化银是中间产物;
C、根据反应机理,反应速率取决于慢反应;
D、根据反应机理,理论上0.7mol乙烯参与反应,其中要有0.1mol乙烯被氧化成二氧化碳.
解答 解:A、反应热为:=-106kJ•mol-1,而不是活化能,故A错误;
B、氧化银是中间产物,银单质是催化剂,故B错误;
C、根据反应机理,反应速率取决于慢反应,所以增大乙烯浓度对反应速率影响不大,故C错误;
D、根据反应机理,理论上0.7mol乙烯参与反应,其中要有0.1mol乙烯被氧化成二氧化碳,所以最多可得到0.6mol环氧乙烷,故D正确;
故选D.
点评 本题考查反应热、催化剂、外界条件对反应速率的影响和转化率的知识,综合性强,实际上考查学生对基础知识的掌握,但比较容易.


科目:高中化学 来源: 题型:选择题
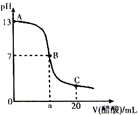 在20mL0.100mol•L-1NaOH溶液中逐滴加入0.200mol•L-1醋酸溶液,曲线如图所示,有关粒子浓度关系比较正确的是( )
在20mL0.100mol•L-1NaOH溶液中逐滴加入0.200mol•L-1醋酸溶液,曲线如图所示,有关粒子浓度关系比较正确的是( )| A. | A点到B点的变化过程中,离子浓度大小关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 在B点a>10,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) | |
| C. | B点到C点的变化过程中,离子浓度大小关系:c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| D. | 在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
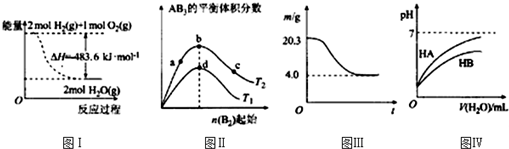
| A. | 图Ⅰ表示H2与O2发生反应过程中的能量变化,则H2的燃烧热△H=-241.8 kJ•mol-1 | |
| B. | 图Ⅱ表示反应A2(g)+3B2(g)?2AB3(g),达到平衡时A2的转化率大小为:b>a>c | |
| C. | 图Ⅲ表示0.1mol MgCl2•6H2O在空气中充分加热时固体质量随时间的变化 | |
| D. | 图Ⅳ表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于同浓度NaB溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
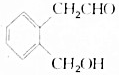 .A可以被新制Cu(OH)2氧化为B;B能在浓硫酸存在和加热时发生分子内的酯化反应生成C,C分子中有一个含氧的六元环.回答下列问题:
.A可以被新制Cu(OH)2氧化为B;B能在浓硫酸存在和加热时发生分子内的酯化反应生成C,C分子中有一个含氧的六元环.回答下列问题: .
. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$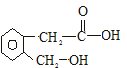 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 步 骤 | 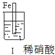 | 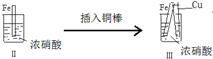 | |
| 现 象 | 铁表面产生大量无色气泡,液面上方变为红棕色 | 铁表面产生少量红棕色气泡后,迅速停止 | 铁、铜接触后,其表面均产生红棕色气泡 |
| A. | Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2→2NO2 | |
| B. | Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应 | |
| C. | 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 | |
| D. | 针对III中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③②① | C. | ②①③ | D. | ②③① |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 | |
| B. | 该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 | |
| C. | 加入适量的NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 加入适量氨水后,c(CH3COO-)会大于c(Na+)、c(NH4+)之和 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com