
| A. | Ca(ClO)2 | B. | CaCl2 | C. | Ca(OH)2 | D. | CaCO3 |
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:选择题
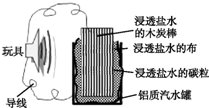 利用生活中常见的材料可以进行很多科学实验,下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,有关说法中正确的是( )
利用生活中常见的材料可以进行很多科学实验,下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,有关说法中正确的是( )| A. | 铝罐不会被腐蚀 | |
| B. | 木炭棒上发生的反应为O2+2H2O+4e-═4OH- | |
| C. | 木炭棒应与玩具电机的负极相连 | |
| D. | 该电池工作一段时间后木炭棒和碳粒的质量会减轻 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:R>Z>Y | |
| B. | X的最简单气态氢化物分子中含有18个电子 | |
| C. | Y与Z形成的常见化合物既能与酸反应,又能与碱反应 | |
| D. | 同周期元素中R的最高价氧化物对应水化物的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
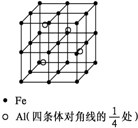 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备催化剂的元素 | B. | 耐高温的合金元素 | ||
| C. | 用于半导体材料的元素 | D. | 制备农药的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | NH4NO3 | NaOH | NaCl | KNO3 |
| 溶解热(kJ/kg) | -330.75 | +1040.5 | -84.10 | -353.17 |
| A. | NH4NO3 | B. | NaOH | C. | NaCl | D. | KNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com