
| A. | CH4 | B. | NH3 | C. | H2O | D. | CO2 |
分析 在分子中,中心原子上孤电子对之间的排斥力>孤电子对和成键电子之间的排斥力>成键电子之间的排斥力,则含有孤电子对越多,分子中的键角越小.
解答 解:在分子中,中心原子上孤电子对之间的排斥力>孤电子对和成键电子之间的排斥力>成键电子之间的排斥力,
则含有孤电子对越多,分子中的键角越小,CH4分子中C原子不含孤电子对,NH3分子中N原子含有1个孤电子对,H2O中O原子含有2个孤电子对,CO2中C原子不含孤电子对,所以键角最小的是H2O,
故选C.
点评 本题考查了键角大小的判断,根据“在分子中,中心原子上孤电子对之间的排斥力>孤电子对和成键电子之间的排斥力>成键电子之间的排斥力>,则含有孤电子对越多,分子中的键角越小”来分析解答即可.


科目:高中化学 来源: 题型:选择题
| A. | 离子半径:O2->Na+>Mg2+>Al3+>F- | |
| B. | 热稳定性:HCl>H2S>PH3>AsH3 | |
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4<H2SO4 | |
| D. | 碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
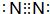 ;B的原子在周期表中的位置是第三周期ⅡA族
;B的原子在周期表中的位置是第三周期ⅡA族
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
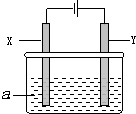
| 方案 | X | Y | a溶液 |
| A | 铁 | 银 | AgNO3 |
| B | 铁 | 银 | Fe(NO3)3 |
| C | 银 | 铁 | AgNO3 |
| D | 银 | 石墨 | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不用稀硫酸,改用98%的浓硫酸 | B. | 加热 | ||
| C. | 适当增大稀硫酸的浓度 | D. | 不用铁片,改用铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入适量NaNO3溶液 | B. | 加入适量NaOH溶液 | ||
| C. | 加入适量Na2CO3溶液 | D. | 加入适量NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com