
【题目】下列事实不能用勒夏特列原理解释的是( )
A.加入催化剂可以加快合成氨的速率
B.新制的氯水在光照条件下颜色变浅
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
【答案】A
【解析】
A.催化剂只能改变反应速率不能影响化学平衡移动,不能用勒夏特列原理解释,A正确;
B.氯水中存在平衡Cl2+H2O![]() HCl+HClO,光照次氯酸分解,次氯酸浓度降低,平衡正向移动,能用勒夏特列原理解释,B错误;
HCl+HClO,光照次氯酸分解,次氯酸浓度降低,平衡正向移动,能用勒夏特列原理解释,B错误;
C.氯化钠在溶液中完全电离,所以饱和食盐水中含有大量的氯离子,氯气溶于水是可逆反应,Cl2+H2O![]() H++Cl-+HClO,通入饱和食盐水中相当于增大氯离子的浓度,平衡逆向移动,氯气溶解量减小,能用勒夏特列原理解释,C错误;
H++Cl-+HClO,通入饱和食盐水中相当于增大氯离子的浓度,平衡逆向移动,氯气溶解量减小,能用勒夏特列原理解释,C错误;
D.工业上生产硫酸的过程中存在平衡2SO2+O2![]() 2SO3,使用过量的空气,增大了氧气的浓度,平衡正向移动,提高了二氧化硫的利用率,能用勒夏特列原理解释,D错误;
2SO3,使用过量的空气,增大了氧气的浓度,平衡正向移动,提高了二氧化硫的利用率,能用勒夏特列原理解释,D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】在下列反应中,HCl作氧化剂的是( )
A.NaOH+HCl=NaCl+H2O
B.Zn+2HCl=ZnCl2+H2↑
C.MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.CuO+2HCl=CuCl2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将3 mol A和1 mol B两种气体混合于容积为2L的密闭容器中,发生如下反应:2A(g)+B(g)![]() xC(g)+ 2D(g)。2 min末该反应达到平衡,生成1.0 mol D,并测得C的浓度为0.25 mol/L。下列判断错误的是( )
xC(g)+ 2D(g)。2 min末该反应达到平衡,生成1.0 mol D,并测得C的浓度为0.25 mol/L。下列判断错误的是( )
A. 平衡常数约为0.25
B. B的转化率为50%
C. A的平均反应速率为0.25 mol/( L·min)
D. 若反应前后压强之比为4:3则表明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验需要480mL 0.5mol/L的NaOH溶液,请回答下列问题:
(1)应称取NaOH的质量______g,应选用容量瓶的规格是_______mL。
(2)除容量瓶外还需要的其它玻璃仪器是________、________及玻璃棒
(3)配制时,其正确的操作顺序是(用字母表示,每个操作只能用一次)________。
A 将容量瓶盖紧,振荡,摇匀
B 用托盘天平准确称量所需的NaOH质量,倒入烧杯中,再加入适量水,用玻璃棒慢慢搅动,使其溶解(必要时可加热)
C 用适量水洗涤烧杯2-3次,洗涤液均注入容量瓶中,振荡
D 改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
E 将已冷却的溶液沿玻璃棒注入容量瓶中
F 继续往容量瓶内小心加水,直到液面接近刻度1-2cm 处
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)没有进行C操作________;配制溶液时,定容时仰视刻度线 ________;容量瓶未干燥________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2![]() CO2+H2O △H<0。下列有关说法正确的是( )
CO2+H2O △H<0。下列有关说法正确的是( )
A. 该反应为吸热反应
B. CO2分子中的化学键为非极性键
C. HCHO分子中既含σ键又含π键
D. 每生成1.8g H2O消耗2.24 L O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氢键,下列说法正确的是( )
A. 每一个水分子内含有两个氢键
B. 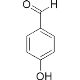 的熔沸点明显高于
的熔沸点明显高于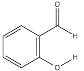 ,对羟基苯甲醛分子间存在氢键,而邻羟基苯甲醛存在分子内氢键。
,对羟基苯甲醛分子间存在氢键,而邻羟基苯甲醛存在分子内氢键。
C. H2O是一种非常稳定的化合物,这是由于氢键所致
D. SO2易溶于水,重要的原因之一是由于SO2与H2O之间能形成氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜和镁的合金4.6 g完全溶于浓硝酸,若反应中硝酸被还原只产生4 480 mL NO2气体和336 mL的N2O4气体(气体的体积已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为 ( )
A.9.02 gB.8.51 gC.8.26 gD.7.04 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲验证:“铜和一定量的浓硝酸反应有一氧化氮产生”。设计使用了如图装置进行实验。(假设气体体积均为标准状况,导气管中气体体积忽略不计,且忽略反应中的溶液体积变化)
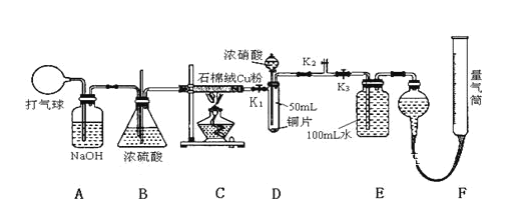
试回答下列问题:
(1)在铜和浓硝酸反应前,挤压打气球(球内充满空气),经A、B、C反应后,气体进入D中,通入该气体的目的是_______;进行此步操作时应关闭_______,打开_____(填K1、K2或K3,上同)。
(2)关闭K1、K2,打开K3,由分液漏斗向D中滴加浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入CCl4至满。则D中一定发生反应的离子方程式为:___。
(3)若E装置中出现倒吸,可采取的应急操作是____________;
(4)若测得反应后E装置中HNO3的浓度为0.072mol/L,F装置所收集到的气体体积为139.00 mL,则铜和一定量的浓硝酸反应___(填“有”或“无”)NO生成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的铁和铜的混合物24g 与600mL稀硝酸恰好完全反应,生成NO 6.72L(标准状况),向反应后的溶液中加入1mol·L—1 NaOH溶液使金属离子恰好沉淀,过滤。下列有关说法错误的是( )
A. 混合物溶解后的溶液中c(Fe3+):c(Fe2+)=1:1 B. 稀硝酸的物质的量浓度是2 mol·L—1
C. 需加入NaOH溶液1000mL D. 最后所得沉淀在空气中充分加热可得固体32g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com