
【题目】氧族元素是指位于元素周期表第16列的元素,包括氧、硫、硒(Se)、碲(Te)、钋(Po)五种元素。请回答下列问题:
(1)与氧同周期的相邻的元素中,第一电离能由大到小的顺序为________________。(填元素符号)
(2)气态SO3分子的空间构型为______________;与其互为等电子体的阴离子为___________(举一例)。
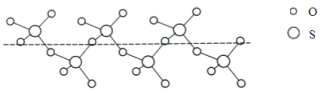
(3)将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如下图,此固态SO3中S原子的杂化轨道类型是_____________。
(4)元素X与硒同周期,X元素原子核外未成对电子数最多,X为_________(填元素符号);X的基态原子的电子排布式为___________________。
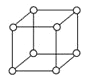
(5)单质钋是由___________键形成的晶体;有资料表明,只有钋的晶体中的原子具有如图所示的堆积方式,若已知Po的摩尔质量为M g·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA,则钋晶体的密度的表达式为____________g/cm3。
【答案】 (1)F N O (2)平面正三角形;NO3-、CO32-等 (3)sp3
(4)Cr;1s22s22p63s23p63d54s1 (5)金属键,1030M/(8NAr3)
【解析】
试题分析:(1)与O同周期的相邻元素为N和F,同一周期元素,元素的第一电离能随着原子序数增大而增大,其中N元素的2p轨道电子处于半充满状态,稳定性较强,则第一电离能大小的顺序为:F>N>O;
(2)SO3中价电子对为3,没有孤对电子,为平面三角形;价电子数和原子数分别都相等的互为等电子体,则与其互为等电子体的阴离子为NO3-、CO32-等;
(3)图中固态SO3中S原子形成4个共价单键,其杂化轨道类型是sp3;
(4)元素X与硒同周期,X元素原子核外未成对电子数最多,则X为24号元素Cr,Cr的基态原子的电子排布式为1s22s22p63s23p63d54s1;
(5)单质钋是由金属键形成的晶体,属于简单立方堆积,一个晶胞中含有1个原子,如果原子半径为rpm,则晶胞的边长是2rpm,则钋晶体的密度的表达式为![]() 。
。


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A、地震发生后,灾区急需大量消毒剂,其中SO2可用于环境消毒
B、乙烯能使溴水和酸性高锰酸钾溶液褪色,其褪色原理相同
C、利用太阳能等清洁能源代替化石燃料,有利于节约能源,保护环境
D、工业上用二氧化硅在高温下与焦炭反应制得高纯度的硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年朝鲜进行氢弹试验,引起国际社会的极大关注。下列关于H的说法正确的是
A. 质子数是2 B. 质量数是1 C. 电子数是3 D. 中子数是2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应由两步反应A![]() B
B![]() C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是
C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是
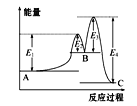
A.两步反应均为吸热反应
B.三种化合物中C最稳定
C.加入催化剂会改变反应的能量变化
D.整个反应中能量变化:ΔH=E1-E4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法中正确的是
①常温下,0.1molCl2与足量NaOH溶液反应,转移的电子数目为0.2NA
②常温常压下,18gH2O中含有的电子总数为10NA
③将100 mL 0.1 mol·L-1FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
④在反应KIO3+6HI==KI+3I2+3H2O中,每生成3 mol I2转移的电子数为5NA
⑤常温常压下,14g的C2H4和C4H8混合气体中含有的原子数为3NA
⑥在标准状况下,0.5molNO与0.5molO2混合后气体分子数为0.75 NA
⑦1.0L 1.0 mol·L-1 Na2SiO3水溶液中含有的氧原子数为3NA
A.①⑤⑦ B.③④⑥
C.②④⑤ D.②③⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是( )
A.NO2、Cl2O7都是酸性氧化物
B.水银、水玻璃都是混合物
C.HD、HCHO都是化合物
D.干冰、可燃冰都是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以黄磷(P4)为原料制备次磷酸钠晶体的工艺流程如图所示:
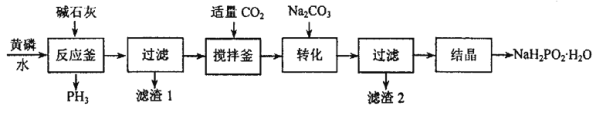
(1)反应釜中被氧化的元素是________,PH3可以除去溶液中的Cu2+,反应为:24CuSO4+11PH3+12H2O=8Cu3P↓+3H3PO4+24H2SO4,反应转移12mol电子时,被氧化的PH3的物质的量是____________。
(2)搅拌釜中通入CO2的目的是__________________.
(3)滤渣2的主要成分为____________.
(4)次磷酸钠可用于化学镀.如在塑料镀件上化学镀铜,用含有Cu 2+和H2PO2-的溶液在pH=11条件下反应,次磷酸根离子被氧化为HPO32-,该反应的离子方程式为__________________.化学镀与电镀相比,优点是__________________、__________________(答两点)
(5)H3PO2是一元强酸,H3PO2与足量的NaOH溶液反应的离子方程式是_______________,NaH2PO2溶于水显碱性的原因是_______________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.2g铜与过量硝酸(8 mol·L-1,30 mL)充分反应,硝酸的还原产物为NO2和NO,反应后溶液中含a mol H+,则此时溶液中所含NO3-的物质的量为( )
A.(0.2+a)mol B.(0.1+a)mol
C.(0.05+a)mol D.a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生物体内含量极少,但必不可少的化学元素有( )
A. Fe Mn Zn Mg
B. Zn Cu Mn Ca
C. H 0 Na Mg
D. Zn Cu B Fe
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com