
基态Fe原子有________个未成对电子。Fe3+的电子排布式为________。可用硫氰化钾检验Fe3+,形成的配合物的颜色为________。
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是( )
A.用KIO3氧化酸性溶液中的KI:5I-+IO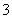 +3H2O===3I2+6OH-
+3H2O===3I2+6OH-
B.向NH4HSO3溶液中加过量的NaOH溶液并加热:NH +OH-
+OH-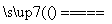 NH3↑+H2O
NH3↑+H2O
C.将过量SO2通入冷氨水中:SO2+NH3·H2O===HSO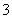 +NH
+NH
D.Ba(OH)2溶液中逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的OH-恰好反应一半时:Ba2++2OH-+2H++SO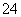 ===BaSO4↓+2H2O
===BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
元素的原子半径在周期表中呈现周期性变化的根本原因是( )
A.原子的相对原子质量呈现周期性变化
B.元素的化合价呈现周期性变化
C.原子的性质呈现周期性变化
D.元素原子的核外电子排布呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
根据前四周期元素原子核外电子排布特点,回答下列问题:
(1)外围电子层有2个未成对电子的有________;有3个未成对电子的有________。
(2)未成对电子数与周期数相等的元素有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,不符合ⅦA族元素性质特征的是( )
A.从上到下原子半径逐渐减小
B.易形成-1价离子
C.从上到下单质的氧化性逐渐减弱
D.从上到下氢化物的稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
回答下列问题:
(1)已知元素M是组成物质NH4Al(SO4)2的一种元素。元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如下表所示:
| I1 | I2 | I3 | I4 | |
| 电离能(kJ·mol-1) | 578 | 1 817 | 2 745 | 11 578 |
元素M是____________(填写元素符号)。
(2)硫原子核外有________种不同运动状态的电子,有________种不同形状的电子云。
(3)请用一个事实证明氧气的氧化性比硫的氧化性强:__________________________。
(4)写出碳原子最外层电子的电子排布图________________,该化学用语不能表达出碳原子最外层电子的________(填字母)。
a.电子层 b.原子轨道
c.所有电子云的伸展方向 d.自旋状态
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)[2014·四川理综,11(3)]已知:25 ℃、101 kPa时,Mn(s)+O2(g)===MnO2(s) ΔH=-520 kJ·mol-1
S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol Mn(s)+S(s)+2O2(g)===MnSO4(s)
ΔH=-1 065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是__________________。
(2)[2014·浙江理综,27(3)]煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)CaO(s)+SO2(g)+CO2(g)
ΔH1=218.4 kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)CaS(s)+4CO2(g)
ΔH2=-175.6 kJ·mol-1(反应Ⅱ)
假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是______。
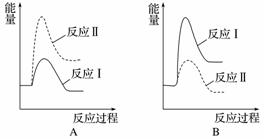
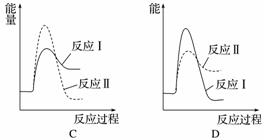
(3)[2014·广东理综,31(1)]用CaSO4代替O2与燃料CO反应,既可提高燃料效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g)1/4CaS(s)+CO2(g)
ΔH1=-47.3 kJ·mol-1
②CaSO4(s)+CO(g)CaO(s)+CO2(g)+SO2(g)
ΔH2=+210.5 kJ·mol-1
③CO(g)1/2C(s)+1/2CO2(g)
ΔH3=-86.2 kJ·mol-1
反应2CaSO4(s)+7CO(g)CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=__________(用ΔH1、ΔH2和ΔH3表示)。
(4)[2014·大纲全国卷,28(1)]化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为____________________________________。
(5)[2014·天津理综,7(4)]晶体硅(熔点1 410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
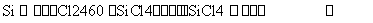
写出SiCl4的电子式:______;在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com