
| 编号 | 酸的种类 | 酸的浓度/mol•L-1 | 酸的体积/mL | 镁条质量/g |
| 1 | 醋酸 | 1.0 | 10 | 2.0 |
| 2 | 盐酸 | c | 10 | 2.0 |
| 待测物理量 | 测定方法 |
| ①醋酸溶液的物质的量浓度 | 量取25.00ml醋酸溶液于锥形瓶中,滴加指示剂,将0.1000 mol•L-1 NaOH标准溶液装入 碱式滴定管,滴定至终点,记录数据.重复滴定2次. |
| ②H+的物质的量浓度 | 取适量醋酸溶液于烧杯中,用pH计测定溶液pH |
分析 (1)①要探究酸的强弱对酸与镁条反应速率的影响,则必须保持其他影响反应速率的因素保持一致,据此分析C的数值;
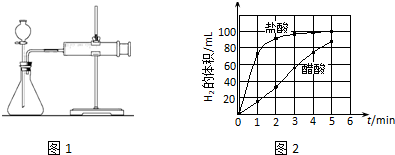
②据图可知,是要通过测量在相同的时间内收集到的氢气体积的大小来测量反应速率,据此分析反应开始后的操作;
③通过图象来分析单位时间内氢气的体积的变化可知醋酸、盐酸与镁条反应的速率的变化情况;
(2)醋酸的电离程度是已电离的电解质分子数占原来总分子数的百分比,故要求醋酸的电离程度,故应测出醋酸溶液的浓度和溶液中H+的浓度,据此分析.
①根据测定方法可知,此为酸碱中和滴定,可测出醋酸溶液的浓度;碱液应盛放在碱式滴定管中;
②由于①能测出醋酸溶液的浓度,故此步实验的目的是测量溶液中H+的浓度,而若较精确的测量溶液的pH,用pH计.
解答 解:(1)①要探究酸的强弱对酸与镁条反应速率的影响,则必须保持其他影响反应速率的因素保持一致,故醋酸和盐酸的浓度应相同,故C也应为1.0mol/L,
故答案为:1.0;
②据图可知,是要通过测量在相同的时间段内收集到的氢气体积的大小来测量反应速率,故在反应开始后,应每隔1min记录一次生成H2的体积,
故答案为:每隔1min记录一次生成H2的体积;
③通过图象分析可知,单位时间内醋酸与镁条反应生成氢气的体积变化很小,即醋酸与镁条的反应速率变化不大;而盐酸与镁条的反应一开始很快,一段时间后,单位时间内生成的氢气的体积明显变小,即反应速率明显减小,
故答案为:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小;
(2)醋酸的电离程度是已电离的电解质分子数占原来总分子数的百分比,故要求醋酸的电离程度,故应测出醋酸溶液的浓度和溶液中H+的浓度.
①根据测定方法可知,此为酸碱中和滴定,所给的NaOH溶液是标准液,即醋酸是待测液,通过滴定,可测出醋酸溶液的浓度;碱液应盛放在碱式滴定管中;
醋酸溶液的物质的量浓度;
②由于①能测出醋酸溶液的浓度,故此步实验的目的是测量溶液中H+的浓度,而若较精确的测量溶液的pH,应该用pH计,方法是取适量醋酸溶液于烧杯中,用pH计测定溶液pH.故答案为:
| 待测物理量 | 测定方法 |
| 醋酸溶液的物质的量浓度 | 碱式滴定管 |
| H+的物质的量浓度 | 取适量醋酸溶液于烧杯中,用pH计测定溶液pH |
点评 本题考查了影响反应速率的因素、实验方案的设计以及图象问题,综合性较强,是高考的高频考点.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | 阳极反应式相同 | |
| B. | 电解结束后所得液体的pH相同 | |
| C. | 阴极反应式相同 | |
| D. | 通过相同电量时生成的气体总体积相等(同温同压) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
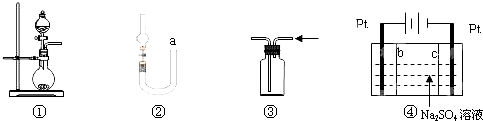
| A. | 图①可用于制取少量NH3或用MnO2和浓盐酸制取Cl2 | |
| B. | 可用从a处加水的方法检验图②装置的气密性 | |
| C. | 实验室可用图③的方法收集Cl2或NH3 | |
| D. | 利用图④装置制硫酸和氢氧化钠,其中c为阴离子交换膜、b为阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H=2△H1+△H2+△H3 | B. | △H=△H1+△H2+△H3 | ||
| C. | △H=△H1+2△H2+2△H3 | D. | △H=2△H1+△H2-△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用图1所示装置可收集NO气体 | |
| B. | 用图4装置可证明酸性:H2SO4>H2CO3>H2SiO3 | |
| C. | 用图3所示装置可实现反应:2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+H2↑ | |
| D. | 用图2所示装置可吸收多余氨气且能防止倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{\;}^{16}$O和${\;}_{\;}^{18}$O的物理性质相同、化学性质不相同 | |
| B. | 通过化学反应可实现${\;}_{\;}^{16}$O与${\;}_{\;}^{18}$O之间相互转化 | |
| C. | ${\;}_{\;}^{16}$O和${\;}_{\;}^{18}$O的原子核外电子排布的方式不相同 | |
| D. | ${\;}_{\;}^{16}$O和${\;}_{\;}^{18}$O能形成三种化学性质相同的氧分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12种 | B. | 10种 | C. | 8种 | D. | 14种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向次氯酸钙溶液中通入SO2:Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO | |
| B. | Fe3O4与稀硝酸反应:Fe3O4+8H+=2Fe2++Fe3++4H2O | |
| C. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| D. | 溶液中FeBr2与等物质的量的Cl2反应:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com