
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有CaCl2、MgCl2、Na2SO4以及泥沙等杂质,以下是制备精盐的实验方案,步骤如图:
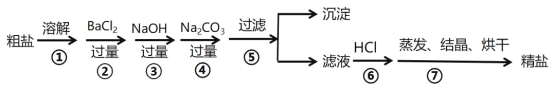
(1)在第①步粗盐溶解操作中要用到玻璃棒搅拌,其目的是_________________;
(2)第②步操作的目的是除去粗盐中的______________;( 填化学式,下同)
(3)第④步操作的目的是除去粗盐中的_____________、______________;,写出相应的离子反应方程式:_______________________;_________________________;
【答案】搅拌、加速溶解 Na2SO4 CaCl2 BaCl2 Ca2++CO32﹣=CaCO3↓ Ba2++CO32﹣=BaCO3↓
【解析】
除去粗盐中的泥沙、CaCl2、MgCl2、Na2SO4杂质,即除去镁离子、钙离子、硫酸根离子和泥沙,镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,样品溶解之后,可先加入氢氧化钠除去氯化镁,再加入氯化钡除去硫酸钠,或先加入氯化钡除去硫酸钠,再加入氢氧化钠除去氯化镁,最后加入碳酸钠,以除去CaCl2和过量的BaCl2,过滤要放在所有的沉淀操作之后,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,最后进行蒸发、结晶、烘干等操作得到精盐,以此解答该题。
(1)粗盐溶解操作中要用玻璃棒搅拌,加速了液体的流动,使固体很快溶解,即目的是搅拌、加速溶解;
(2)第②步操作加入过量的氯化钡,其目的是除去粗盐中的硫酸钠,化学式为Na2SO4;
(3)第④步操作加入过量的碳酸钠,其目的是除去粗盐中的氯化钙以及过量的氯化钡,化学式分别是CaCl2、BaCl2,反应的离子方程式分别为Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是 ( )
A. 向稀HNO3中滴加Na2SO3溶液: SO32-+2H+SO2↑+H2O
B. Na2CO3溶液中CO32-的水解:CO32-+H2O==HCO3-+OH-
C. 向Al2(SO4)3溶液中加入过量的NH3·H2O: Al3++4NH3·H2O[Al(OH)4]-+4N![]()
D. 向CuSO4溶液中加Na2O2:2Na2O2+2Cu2++2H2O4Na++2Cu(OH)2↓+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列反应:
①2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
②CaO+H2O=Ca(OH)2
③Ba(OH)2+H2SO4=BaSO4↓+2H2O
④Zn+2HCl=ZnCl2+H2↑
⑤2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
⑥CaCO3![]() CaO+CO2↑
CaO+CO2↑
⑦2CO+O2![]() 2CO2
2CO2
⑧SO42-+Ba2+=BaSO4↓
(1)既是分解反应又是氧化还原反应的是_____,既是化合反应又是氧化还原反应的是______(均填序号)。
(2)请用单向桥表示反应①的电子转移的方向和数目:________________。其中,该反应的氧化产物是___________,还原产物是__________。
(3)反应③的离子反应方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中所含杂质(括号中的物质)所选用的试剂和装置均正确的是 ( )
Ⅰ.试剂:①KMnO4/H+②NaOH溶液 ③饱和Na2CO3溶液④H2O ⑤Na ⑥Br2/H2O ⑦Br2/CCl4
Ⅱ.装置:

选项 | 物质 | 试剂 | 装置 |
A | C2H6(C2H4) | ⑥ | ① |
B | 苯(苯酚) | ① | ③ |
C | CH3COOC2H5(CH3COOH) | ③ | ② |
D | 甲苯(二甲苯) | ① | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,由N2O和CO2组成的混合气体的密度是C2H4、N2和H2组成的混合气体密度的 2倍,则C2H4、N2和H2组成的混合气体中H2的质量分数为
A. 3/13 B. 10/13 C. 大于3/13,小于10/13 D. 3/143
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列是A、B、C、D、E五种短周期元素的某些性质:
性质 | A | B | C | D | E |
化合价 | -4 | -2 | -1 | -2 | -1 |
电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
(1)元素A是形成有机物的主要元素,下列分子中存在sp和sp3杂化方式的是____(填序号)。
a.![]() b.CH4 c.CH2
b.CH4 c.CH2![]() CHCH3d.CH3CH2C≡CH e.CH3CH3
CHCH3d.CH3CH2C≡CH e.CH3CH3
(2)相同条件下,AD2与BD2分子在水中的溶解度较大的是_______(写化学式)
(3)B、D形成的简单氢化物,沸点:_______更高(写化学式)
II.乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用如图所示装置制备乙酸乙酯。

(1)若实验中用乙酸和乙醇反应,则该装置与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是_______。
(2)若现有乙酸90 g,乙醇138 g,发生酯化反应得到88g乙酸乙酯,试计算该反应的产率为__。
(3)用如图所示的分离操作流程分离含乙酸、乙醇和水的乙酸乙酯粗产品,图中( )内为适当的试剂,[ ]内为适当的分离方法。

试剂a是____;分离方法③是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在臭氧发生器中装入100mLO2,经反应3O2=2 O3,最后气体体积变为95mL(体积均为标准状况下测定),则反应后混合气体的密度为____________。
(2)将溶质质量分数为a%NaOH溶液蒸发掉m g水后,变成VmL 2a%的NaOH不饱和溶液,则蒸发后的溶液的物质的量浓度是__________。
(3)amolH2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为_______。
(4)现有CO、CO2、O3(臭氧)三种气体,它们分别都含有1mol氧原子,则三种气体的质量之比为________(最简整数比)。
(5)标准状况下,密度为0.75g/L 的NH3与CH4组成的混合气体中,NH3的体积分数为__________,该混合气体对氢气的相对密度为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com