
分析 A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A、D都能与C按原子个数比为1:1的过氧化氢或2:1形成化合物水,则A为H元素;C元素是氧元素,D是钠元素;A、B组成的气态化合物可以与B的最高价氧化物的水化物反应生成一种盐M,则B为N元素;E与C的最外层电子数相同,则E是硫元素,由此分析解答.
解答 解:A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A、D都能与C按原子个数比为1:1的过氧化氢或2:1形成化合物水,则A为H元素;C元素是氧元素,D是钠元素,A、B组成的气态化合物可以与B的最高价氧化物的水化物反应生成一种盐M,M为硝酸铵,则B为N元素;E与C的最外层电子数相同,则E是硫元素,
(1)E(s)+O2(g)═EO2(g)△H1,E(g)+O2(g)═EO2(g)△H2的反应为S(s)+O2(g)═SO2(g)△H1,S(g)+O2(g)═SO2(g)△H2,由于S固体具有的能量小于硫蒸气,则硫蒸气与氧气反应放热的热量多,焓变为负值,则△H1>△H2,
故答案为:>;
(2)硝酸铵中含有的化学键有离子键和共价键,硫元素在周期表中的位置是第三周期ⅥA,
故答案为:离子键和共价键;第三周期ⅥA族;
(3)向100mL 0.1mol•L-1氢氧化钠溶液中通入224mLH2S(标准状况下)气体,两者恰好完全反应生成硫氢化钠,硫氢化钠溶液水解程度大于电离,所得溶液呈碱性,水解程度大于电离程度,c(OH-)>c(H+),所以离子浓度关系为:c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-),
故答案为:硫氢化钠溶液水解程度大于电离程度;c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-);
(4)非金属性越强氢化物越稳定,所以N、O所形成氢化物的稳定性由强到弱的顺序是:H2O>NH3,
故答案为:H2O>NH3;
(5)以N2、H2为电极反应物,以HCl-NH4Cl溶液为电解质溶液制造新型燃料电池,正极发生还原反应,氮气在正极得到电子,酸性条件下生成NH4+,正极电极反应为N2+8H++6e-═2NH4+,原电池中阳离子向正极移动,
故答案为:N2+8H++6e-═2NH4+;正.
点评 本题考查了原子结构与元素周期律的综合应用,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 55 | SO2 | II | 良 |
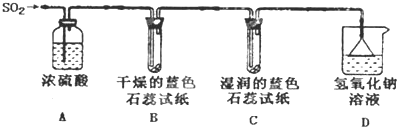
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L庚烷的分子数约为NA | |
| B. | 1L 0.1mol•L-l的Na2S溶液中S2-和HS-的总数为0.1NA | |
| C. | 4.0 gH218O与D2O的混合物中所含中子数为2NA | |
| D. | 50mL 12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 探究Na与水的反应可能有O2生成 | |
| B. | 探究SO2和Na2O2反应可能有Na2SO4生成 | |
| C. | 探究足量的铜与一定量的浓硝酸反应的气体产物是NO还是NO2 | |
| D. | 探究向滴有酚酞试液的NaOH溶液中通入Cl2,酚酞红色褪去的现象是溶液的酸碱性改变所致,还是HClO的漂白性所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀锌铁的镀层破损后,镀层仍然对铁起保护作用 | |
| B. | 根据分散质微粒直径大小可以将分散系分为溶液、胶体和浊液 | |
| C. | Cl2与SO2使品红溶液褪色的原理相同 | |
| D. | SiO2可用于制造光导纤维,其性质稳定,不溶于强酸,但是能溶于强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
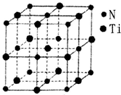 金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值.请回答下列问题:
金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值.请回答下列问题:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下2.24L C12溶于水,发生反应转移的电子数一定为0.1NA | |
| B. | 1 mol的羟基(-OH)和l mol的OH-所含电子数均为1NA | |
| C. | 常温常压下,1.6gCH4中含有共价键总数为0.4NA | |
| D. | 室温下,1L 0.1mol•L-1CH3COONH4溶液中NH4+离子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
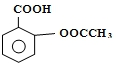 阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )
阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )| A. | 与乙酰水杨酸具有相同官能团的芳香族同分异构体共有8种(不考虑立体异构) | |
| B. | 乙酰水杨酸能发生取代、加成、氧化、还原反应 | |
| C. | 乙酰水杨酸的所有原子均在同一平面上 | |
| D. | 服用阿司匹林药量过大时,可出现精神错乱、惊厥甚至昏迷等水杨酸反应,可用硼酸溶液解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 现象或操作 | 解释或结论 |
| A | KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去 | SO2具有漂白性 |
| B | 在0.1mol•L-1的CH3COONa溶液中,加2滴酚酞显浅红色,微热,溶液颜色加深 | 盐类水解反应是吸热反应 |
| C | 向少量火柴头的浸泡溶液中滴加AgNO3、HNO3和NaNO2混合溶液后,产生白色沉淀 | 火柴头里含有氯元素 |
| D | 蒸馏时,温度计的球泡应靠近蒸馏烧瓶支管口处 | 此位置指示的是馏出物的沸点 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com