
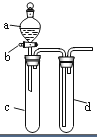
 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.
某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.| 方案 | 反应物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
分析 (1)实验前要检查装置气密性;
(2)浓硝酸和铜反应生成硝酸铜、二氧化氮和水;二氧化氮能与水反应生成硝酸和一氧化氮;
(3)方案丙是利用铜和氧气反应生成氧化铜,氧化铜和硝酸反应生成硝酸铜,反应过程中无污染气体生成;
解答 解:(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c.其目的是检查装置的气密性,
故答案为:检查装置的气密性;
(2)浓硝酸和铜反应生成硝酸铜、二氧化氮和水,反应的化学方程式Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(3)方案甲是铜和浓硝酸反应生成硝酸铜,二氧化氮和水,有污染气体生成,不能体现绿色化学理念;方案乙是稀硝酸和铜反应生成硝酸铜,一氧化氮和水,有污染气体生成,不能体现绿色化学理念;丙是利用铜和氧气反应生成氧化铜,氧化铜和硝酸反应生成硝酸铜,反应过程中无污染气体生成,能体现绿色化学理念,
故答案为:丙;
(4)要证明酸性强弱,应该采用强酸制取弱酸的方法检验,盐酸酸性最强,所以a中盛放硝酸,盐酸和碳酸钙制取二氧化碳,二氧化碳和硅酸钠溶液生成硅酸,则c中盛放碳酸钙、d中盛放硅酸钠,硅酸难溶于水,所以二氧化碳和硅酸钠反应生成硅酸沉淀,看到的现象是有白色沉淀生成,因盐酸易挥发,应在c和d之间加入除杂装置,用饱和碳酸氢钠溶液除去氯化氢,
故答案为:稀盐酸;大理石(或Na2CO3固体);Na2SiO3溶液;c中有气泡产生,d中生成白色胶状物质(或白色沉淀);在c、d之间连接一个盛有饱和NaHCO3溶液的洗气瓶.
点评 本题考查性质实验方案设计,侧重考查学生分析判断及知识运用能力,明确实验原理是解本题关键,注意:(4)装置设计不很合理,生成的二氧化碳中含有盐酸,盐酸和硅酸钠反应也生成白色沉淀,所以在d装置前应该有一个洗气装置,防止吸收干扰实验.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
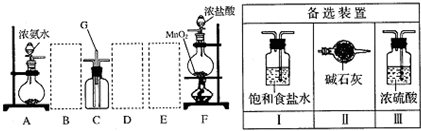
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
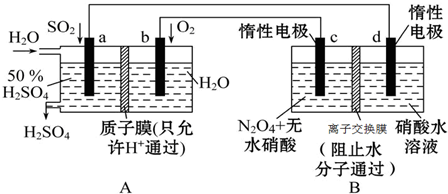
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作步骤 | 预期现象与结论 |
| 步骤1:观察样品 | 溶液呈蓝绿色,①不能(填“能”或“不能”)确定产物中铁元素的价态 |
| 步骤2: 取少量溶液,滴加酸性KMnO4溶液 | ②若KMnO4溶液的紫红色褪去或变浅,说明产物中含+2价铁元素,若KMnO4溶液不褪色或红色不变浅,说明产物中不含+2价铁元素 |
| 步骤3:③另取少量溶液,滴加KSCN溶液 | 若溶液变为红色,说明产物中含+3价的铁元素;若溶液颜色无明显变化,则说明产物中不含+3价的铁元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | 1OCI-+2MnO4一+16H+═2Mn2++5Cl2↑+8H2O | |
| C. | 2Cu+C12$\frac{\underline{\;点燃\;}}{\;}$2CuC12 | |
| D. | 5Pb2++2MnO4一+2H2O═5PbO2+2Mn2++4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾净水:Al3++3H2O∧Al(OH)3+3H+ | |
| B. | 氯气通入水中:Cl2+H2O?2H++ClO-+Cl- | |
| C. | 铜和硝酸银溶液反应:Cu+2Ag+═Cu2++2Ag | |
| D. | 稀硫酸与氢氧化钡溶液反应:Ba2++OH-+H++SO42-═H2O+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醛基的电子式: | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 尿素[CO(NH2)2]是一种有机物 | D. | 聚丙烯的化学式: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com