
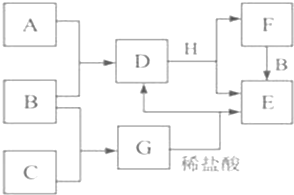
 A-H�ֱ�����ѧ��ѧ�еij������ʣ�����֮������ͼ��ʾ��ϵ����Ӧ������Ҫ�������ɵ�ˮ��û���г�������֪B��HΪ�����Ľ������ʣ�A��C��Ϊ���嵥����A�������ɫΪ����ɫ��F��ˮ��ҺΪ��ɫ��B��D��G��E�о���ͬһ��Ԫ�أ���ش�
A-H�ֱ�����ѧ��ѧ�еij������ʣ�����֮������ͼ��ʾ��ϵ����Ӧ������Ҫ�������ɵ�ˮ��û���г�������֪B��HΪ�����Ľ������ʣ�A��C��Ϊ���嵥����A�������ɫΪ����ɫ��F��ˮ��ҺΪ��ɫ��B��D��G��E�о���ͬһ��Ԫ�أ���ش�

 ��������״Ԫ��ϵ�д�
��������״Ԫ��ϵ�д� �ƸԿ�����ҵ��ϵ�д�
�ƸԿ�����ҵ��ϵ�д� ��Ԫ����ĩ��ϰ�ȷ��ϵ�д�
��Ԫ����ĩ��ϰ�ȷ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������NH4HCO3������״̬��NH4HCO3�TNH4++HCO3? |
| B��CO2ͨ��ˮ�еõ�H2CO3��H2CO3�T2H++CO32? |
| C������������ˮ��CH3COONa�TCH3COO-+Na+ |
| D��C2H5OH����ˮ��C2H5OH�TC2H5++OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��x=y | B��x=2y |
| C��x=3y | D�����Ͼ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A������һ�ȴ�����6�� |
B�����Ͷ�������  ����Ϊͬ���칹�� ����Ϊͬ���칹�� |
| C��һ�������£����ֱ���Է����ӳɡ�ȡ���������ȷ�Ӧ |
| D�����ķ��������е�̼ԭ��һ����ͬһ��ƽ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��һ�����ܺȺ���ʳ�ε�ˮ����Ϊ������Խ��Խ�� |
| B����úȴ���ˮ����Ϊ����ˮ�����κλ�ѧ���� |
| C����úȺ����Ȼ��Ƶ�ˮ���������Բ��������η� |
| D����ò�������ˮ����Ϊ����ˮ������������Ư�ۻ������������������Щ������ˮ�л������彡�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��
��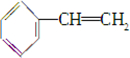 ��
�� ��
�� ��
��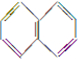 ��
��
| A���ۢ� | B���ڢ� |
| C���٢ڢݢ� | D���ڢۢܢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ��ɲ������·�Ӧ���ϳɼ״���2H2��g��+CO��g���TCH3OH��g��
�״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ��ɲ������·�Ӧ���ϳɼ״���2H2��g��+CO��g���TCH3OH��g��| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com