
已知:①A是石油分解的主要成分,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2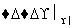 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
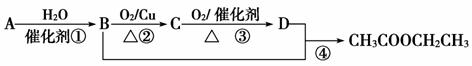
回答下列问题:
(1)写出A的结构式_________________;C的结构简式______________________;
(2)B、D分子中的官能团分别是________________、_________________。
(3)写出下列反应的反应类型:①_______________,②_______________,④________________。
(4)写出下列反应的化学方程式:
①________________________________________________________________________;
②________________________________________________________________________;
④________________________________________________________________________。
科目:高中化学 来源: 题型:
下表是稀硫酸与某金属反应的实验数据:
| 实验序号 | 金属质量 | 金属状态 | c(H2SO4) /mol·L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
分析上述数据,回答下列问题:
(1)实验4和5表明,________________对反应速率有影响,______________反应速率越快,能表明同一规律的实验还有__________(填实验序号);
(2)实验1、3、4、6、8表明反应物浓度对反应速率产生影响,能表明同一规律的实验还有______________(填实验序号);
(3)本实验中影响反应速率的其他因素还有________,其实验序号是6和________,8和__________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用价层电子对互斥理论预测NH3和BF3的空间构型,结论正确的是 ( )
A.直线形;三角锥形 B.V形;三角锥形
C.三角锥形;平面三角形 D.直线形;平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应2SO2+O2 2SO3,在混合气体中充入一定量的18O2,足够长时间后,18O原子( )
2SO3,在混合气体中充入一定量的18O2,足够长时间后,18O原子( )
A.存在于SO2、O2、SO3中 B.只存在于SO2、O2中
C.只存在于O2、SO3中 D.只存在于SO3中
查看答案和解析>>
科目:高中化学 来源: 题型:
关于乙醇的说法中正确的是( )
A.乙醇结构中有—OH,所以乙醇溶解于水,可以电离出OH-而显碱性
B.乙醇燃烧生成二氧化碳和水,说明乙醇具有氧化性
C.乙醇与钠反应可以产生氢气,所以乙醇显酸性
D.乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2SO2+O2 2SO3为放热反应,关于该反应的下列说法正确的是
2SO3为放热反应,关于该反应的下列说法正确的是
A.O2的能量一定高于SO2的能量 B.SO2和O2的总能量一定高于SO3的总能量
C.SO2的能量一定高于SO3的能量 D.因该反应放热,故不必加热反应就可发生
查看答案和解析>>
科目:高中化学 来源: 题型:
人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)蓄电池在放电时起原电池作用,在充电时起电解池的作用。铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
正极电极反应式为____________ ____ 。
(2)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu=2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为________________,当线路中转移0.2mol电子时,则被腐蚀铜的质量为 g
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为___________ _____。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片
(4)燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:
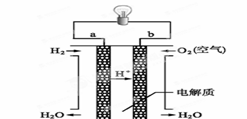
① 氢氧燃料电池的总反应化学方程式是:_________ ___。
② 电池工作一段时间后硫酸溶液的浓度____ _____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com