
【题目】A、B、C三种物质中均含有同一种元素,它们之间有如下图所示的转化关系(部分反应物质已略去)下列说法不正确的是
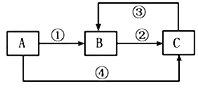
A. 若A是一种两性氧化物,则B的水溶液可呈酸性,C的水溶液可呈碱性
B. 若A是一种金属单质,则反应①②③均可为化合反应,反应④可为置换反应
C. 若A、B均是可燃性物质,完全燃烧都生成气体C,常温下A溶液PH<7,则将C通入A溶液中,pH先减小后增大
D. 若A、B、C是三种不同类别的固体物质,则B可以是工业上制取A、C的原料
【答案】C
【解析】
A.若A是一种两性氧化物,A是氧化铝,则B是氯化铝、C是偏铝酸钠,偏铝酸钠溶液呈碱性,故A正确;
B.若A单质铁,B是氯化铁、C是氯化亚铁,则反应①是铁与氯气反应生成氯化铁、反应②是氯化铁和铁反应生成氯化亚铁、反应③是氯化亚铁和氯气反应生成氯化铁,反应④是铁与盐酸反应生成氯化亚铁和氢气,故B正确;
C.若A、B均是可燃性物质,完全燃烧都生成气体C、常温下A溶液pH<7,则A是H2S、B是S、C是SO2;则将SO2通入H2S溶液中生成单质硫和水,pH值先增大,二氧化硫过量后生成亚硫酸,后PH减小,故C错误;
D.若A是Na、B是NaCl、C是NaOH,工业上电解熔融的氯化钠制取金属钠,电解氯化钠溶液制取氢氧化钠,故D正确;
综上所述,本题选C。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯。在实验室我们可以用如图所示的装置来制取乙酸乙酯。回答下列问题:
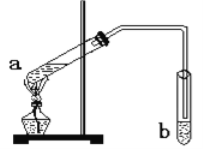
(1)写出试管a中发生的化学方程式:_____________________________________;
(2)试管b中的导管要在液面的稍上方,不能插入液面以下,其目的是 ________________;
(3)浓硫酸的作用为___________________________________________________;
(4)试管b中所盛的溶液为________________,其主要作用是 _________________________。
(5)分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行:
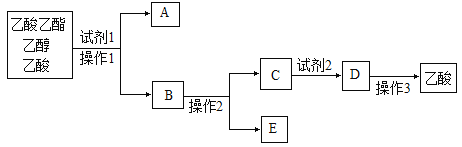
①试剂1最好选用_________________,
②操作1是________________,所用的主要仪器名称是_______________;
③操作2是_____________,试剂2最好选用_______________,操作3是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)若金属钠等活泼金属着火时,应该用_______________来灭火。将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是________。
a.有气体生成 b.钠熔化成小球并在液面上游动
c.烧杯底部有银白色的金属钙生成 d.溶液变浑浊
(2)Na2CO3和NaHCO3是两种常见的钠盐。下列关于Na2CO3和NaHCO3性质的说法中,正确的是______________。
a.常温下,Na2CO3在水中的溶解度比NaHCO3小
b.相同质量的Na2CO3和NaHCO3分别与足量盐酸反应,在相同条件下产生CO2前者多
c.可用Ca(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液
d. NaHCO3溶液中混有少量Na2CO3杂质可通入足量CO2除杂
(3)过氧化钠、过氧化镁都是重要的过氧化物。过氧化镁不溶于水,但易溶于稀酸,广泛用作胃药,治疗胃酸过多。试写出过氧化镁与胃酸反应的离子方程式:_____________。
(4)某无色稀溶液X中,可能含有Al3+、Cl-、Fe3+、Mg2+、NH4+中的某几种,向其中加入NaOH溶液时产生沉淀的物质的量(n)与加入NaOH溶液体积(V)的关系如下图所示。
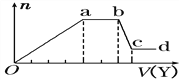
则X中一定含有的阳离子是_________,bc段反应的离子方程式为________。
(5)在1L某酸性溶液中离子浓度的分析结果如下表
离子 | Mg2+ | Al3+ | SO42 | Cl |
c/(mol/L) | 0.5×102 | 1.0×102 | 0.5×102 | 3.0×102 |
向该溶液中逐滴加入0.5 molL-1NaOH溶液至沉淀恰好不再溶解时,消耗NaOH体积为_____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A. 14C中含有 14个中子
B. 1H、2H、3H是同一种核素
C. 根据酸溶液中c(H+)大小,可将酸为强酸和弱酸
D. 根据分散质颗粒大小,可将分散系分为浊液、胶体和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒是一种熔点高、硬度大、无磁性的金属,广泛应用于钢铁、航空航天、能源等领域。工业上利用冶炼铝生成的固体废料——赤泥(主要成分为Fe2O3、Al2O3、V2O5及少量稀土金属氧化物)提取金属钒,其工艺流程图如下:

已知:钒有多种价态,其中+5价最稳定。钒在溶液中主要以![]() 和
和![]() 的形式存在,且存在平衡VO2++H2O
的形式存在,且存在平衡VO2++H2O![]() VO3-+2H+。下列说法正确的是
VO3-+2H+。下列说法正确的是
A. 工业生产中,碱浸步骤可选用较为廉价的氨水
B. 可以推测VO2Cl溶解度大于NH4VO3
C. 焙烧非磁性产品所得的固体产物加酸溶解时,应加入过量盐酸使其溶解完全
D. 将磁性产品加入稀硝酸溶解,取上层清液再加入KSCN溶液后未见红色,则磁性产品中一定不含铁元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示(部分生成物和反应条件已略去)。D、F、G、H均为常见气体,其中D能使湿润的红色石蕊试纸变蓝,G呈黄绿色,H在空气中含量最高;C的摩尔质量为32g·mol-1;E为难溶性碱。
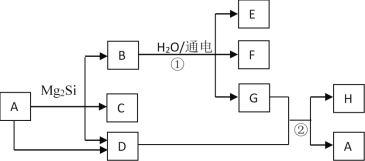
(1)C的化学式为_________;
(2)A的电子式为_________;
(3)写出反应①的离子方程式_______________;
(4)写出反应②的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活、科研密切相关。下列有关说法正确的是( )
A.白酒中混有少量的塑化剂(易溶于酒精),可以通过过滤的方法除去
B.蚕丝的主要成分是蛋白质
C.向燃煤中加入生石灰的目的是减少温室气体的排放
D.油脂在人体内水解为氨基酸,才能被人体吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲探究含硫物质的性质及制备。
(探究一)选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱:
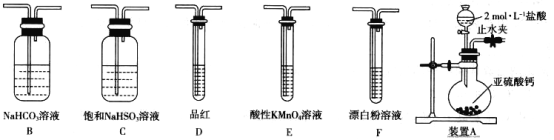
(1)装置A中盛固体的玻璃仪器名称是____________,装置A中反应的离子化学方程式为_______________________________。
(2)装置连接顺序为A、________________,其中装置C的作用是_________,通过现象___________________________,即可证明亚硫酸的酸性强于次氯酸。
(探究二)硫代硫酸钠晶体(Na2S2O3·5H2O,M=248g/mol)可用作定影剂、还原剂。回答下列问题:
(3)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________中溶解,完全溶解后,全部转移至100mL_________中,再定容至凹液面与刻度线相平。
②滴定:取0.00950 mol·L1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72+6I+14H+![]() 3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32
3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32![]() S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当_______________即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当_______________即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
(4)Na2S2O3常用于脱氯剂,在溶液中易被氯气氧化为SO42-,该反应的离子方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.摩尔是基本物理量之一
B.1 mol H2O所含氧的质量为16 g
C.10 L H2比8 L H2所含H2的物质的量更多
D.某物质含有6.02×1023个粒子,那么此物质所占的体积为22.4 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com