
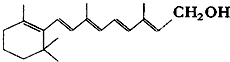
 已知维生素A1的键线式如下,线的交点与端点处代表碳原子,并用氢原子补足四价,但C、H原子未标记出来.
已知维生素A1的键线式如下,线的交点与端点处代表碳原子,并用氢原子补足四价,但C、H原子未标记出来. 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | 同一主族相邻两个周期的元素的原子序数差为上一周期所含元素种类 | |
| B. | 短周期元素中同主族元素X的原子序数不可能是Y的2倍 | |
| C. | L层上的电子数为奇数的元素一定是主族元素 | |
| D. | 目前使用的元素周期表中,最长的周期含36种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
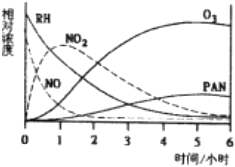
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
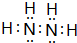
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
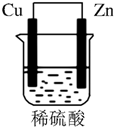 由铜片、锌片和200mL稀H2SO4组成的原电池中(如图所示装置),请按要求填空:
由铜片、锌片和200mL稀H2SO4组成的原电池中(如图所示装置),请按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏可以得到烷烃、环烷烃、芳香烃等产品 | |
| B. | 将石油裂化、裂解,综合利用石油资源 | |
| C. | 有节制地开采煤、石油、天然气等矿物资源 | |
| D. | 用于奥运火炬的丙烷是一种清洁燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

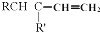
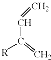 +
+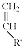 $\stackrel{△}{→}$
$\stackrel{△}{→}$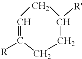
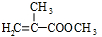 .
.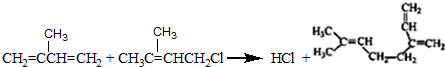 .
.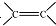 和
和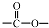 结构的D的所有同分异构共有9种(含顺反异构体),写出其中任意一种含反式结构的结构简式
结构的D的所有同分异构共有9种(含顺反异构体),写出其中任意一种含反式结构的结构简式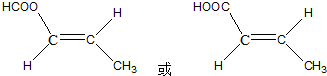 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com