
���ǵ����Ϻ����ḻ��ԭ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á�
��1��25��ʱ��0.1mol/LNH4NO3��Һ��ˮ�ĵ���̶� ������ڡ��������ڡ���С�ڡ��� 0.1mol/L NaOH��Һ��ˮ�ĵ���̶ȡ�
��2������0.1mol/L NaOH��Һ��0.2mol/LNH4NO3��Һ�������ϣ������Һ��2c(NH4+)��c(NO3��)��������Һ������Ũ���ɴ�С��˳���� ��
��3��������ʱ��(N2H4)Ϊȼ�ϣ����������������������߷�Ӧ���ɵ�������̬ˮ�����ⶨ16g������������Ӧ�зų�284kJ����������÷�Ӧ���Ȼ�ѧ����ʽ�� ��
��4����ͼ��1mol NO2��1mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ��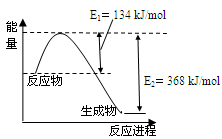
��֪��N2(g)��O2(g)��2NO(g) ��H����180kJ/mol
2NO (g)��O2(g)��2NO2(g) ��H����112.3kJ/mol
��Ӧ��2NO(g)��2CO(g) N2(g)��2CO2(g)�ġ�H�� ��
N2(g)��2CO2(g)�ġ�H�� ��
��1������ ��2��c(NO3��)��c(NH4+)��c(Na+)��c(OH��)��c(H+)
��3��2N2H4(g)��2NO2(g)��3N2(g)��2H2O (g) ��H����1136kJ/mol��4����760.3kJ/mol
������������� ��1���ᡢ������ˮ�ĵ��롢��ˮ����δٽ�ˮ�ĵ��롣
��2��0.1mol/L NaOH��Һ��0.2mol/LNH4NO3��Һ�������Ϻ�c(Na+)=0.05mol/L��c(NO3-)=0.1mol/L����2c(NH4+)��c(NO3��)��c(NH4+)>0.05mol/L������غ�ʽΪc(Na+)+c(NH4+)+c(H+)=c(NO3-)+c(OH-)����c(Na+)��c(NO3-)��c(NH4+)��c(OH��)��c(H+)������c(NO3��)��c(NH4+)��c(Na+)��c(OH��)��c(H+)��
��3��2N2H4��2NO2��3N2��2H2O��16gN2H4Ϊ0.5mol������2molN2H4��Ӧ����1136kJ��
��4����ͼ��ɵ�NO2(g)+CO(g) CO2(g)+NO(g) ��H����234kJ/mol���ɸ�˹���ɵ�2NO(g)��2CO(g)
CO2(g)+NO(g) ��H����234kJ/mol���ɸ�˹���ɵ�2NO(g)��2CO(g) N2(g)��2CO2(g)�ġ�H=����234��2+180+112.3��kJ/mol=��760.3kJ/mol��
N2(g)��2CO2(g)�ġ�H=����234��2+180+112.3��kJ/mol=��760.3kJ/mol��
���㣺 ˮ�ĵ��� ����Ũ�ȱȽ� �Ȼ�ѧ����ʽ ��˹����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(14��)CO2��һ����Ҫ���������壬�о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����塣
��1�����ʯ��ʯīȼ�շ�Ӧ�е������仯��ͼ��ʾ��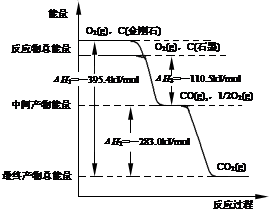
����ͨ��״���£����ʯ��ʯī�У� ������ʯ����ʯī�������ȶ���ʯī��ȼ����Ϊ kJ��mol��1��
��ʯī��CO2��Ӧ����CO���Ȼ�ѧ����ʽ�� ��
��2�����õ绯ѧ���ɽ�CO2ת��Ϊ���顣��д������������ˮ��Һ�������ʱ����ת���ĵ缫��Ӧ����ʽ ��
��3��CO2Ϊԭ�ϻ��ɺϳɶ������ʡ���ҵ�ϳ���CO2(g) ��H2(g)Ϊԭ�Ϻϳ��Ҵ���
����֪��H2O(l)=H2O(g) ��H=+44kJ��mol��1
CO(g)+H2O(g) CO2(g)+H2(g) ��H=��41.2kJ��mol��1
CO2(g)+H2(g) ��H=��41.2kJ��mol��1
2CO(g)+4H2 (g)  CH3CH2OH(g)+H2O(g) ��H= ��256.1kJ��mol��1��
CH3CH2OH(g)+H2O(g) ��H= ��256.1kJ��mol��1��
��2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(l) ��H= ��
CH3CH2OH(g)+3H2O(l) ��H= ��
����ͼ��һ�����̵���Ϊԭ�Ϻϳ��Ҵ��Ĺ���ԭ��ʾ��ͼ��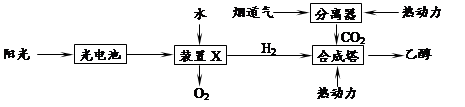
���������̵ķ���������˵����ȷ���� ��
| A�����������ٰ���4����ʽ������ת�� |
| B��װ��X��������ӦΪ��2H2O��4e��=4H++O2�� |
| C���ϳ����������Ҵ��ķ�Ӧ�ǻ��Ϸ�Ӧ |
| D�����������������ɫ��ѧ˼�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ͼa��1 mol NO2��1 mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ��ͼb�Ƿ�Ӧ�е�CO��NO��Ũ����ʱ��仯��ʾ��ͼ������ͼ��ش��������⣺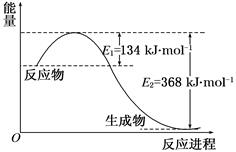
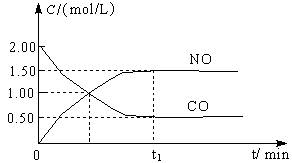
a b
(1)д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ ��
(2)�ӷ�Ӧ��ʼ��ƽ�⣬��NO2Ũ�ȱ仯��ʾƽ����Ӧ����v(NO2)�� ��
(3)���¶��¸÷�Ӧ��ƽ�ⳣ��K= ���¶Ƚ��ͣ�K ����������С�����䡱��
(4)�����¶Ⱥ��ݻ���ͬ�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ���÷�Ӧ�ﵽƽ�ⅼ���й��������±���
| �� �� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 1 mol NO2 1 mol CO | 2 mol NO 2 mol CO2 | 1 mol NO2��1 mol CO 1 mol NO��1 mol CO2 |
| ƽ��ʱc(NO) /mol��L-1 | 1.5 | 3 | m |
| �����仯 | �ų�a kJ | ����b kJ | �ų�c kJ |
| CO��NO��ת���� | ��1 | ��2 | ��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ؾ�ʯ��BaSO4������Ҫ�Ļ���ԭ�ϣ��Ʊ�������������[Ba(OH)2��8H2O]���������£�
��1��д������ʱ������Ӧ���Ȼ�ѧ����ʽ��____________________________��
��2��д�����������������Ȼ�茶����Ϸ�Ӧ�Ļ�ѧ����ʽ��_____________________��
��3��Ϊ�������ʱ������CO���ɽ����ղ���������ͨ��PbCl2��Һ�У����ֺ�ɫ�����Ͳ���һ����ɫ��ζ��ʹ����ʯ��ˮ����ǵ����壬��д���÷�Ӧ�Ļ�ѧ����ʽ��_____��
��4����BaSO4�����м��뱥��Na2CO3��Һ����ֽ��裬��ȥ�ϲ���Һ����˴�����Σ���ʹBaSO4ȫ��ת��ΪBaCO3�������ķ�Ӧ�ɱ�ʾΪ��
BaSO4(s)+CO32��(aq) BaCO3(s)+SO42��(aq)
BaCO3(s)+SO42��(aq)
����0.20 mol BaSO4������1.0L 2.0mol?L��1����Na2CO3��Һ����������c(SO42��)��ʼ��0
ƽ��ʱ��K=4.0x10��2����Ӧ�ﵽƽ��ʱ����ת����BaSO4�����ʵ�����(д��������̽������2λ��Ч����)
��5���Դ�ƽ��ĽǶȽ���BaSO4��ת��ΪBaCO3��ԭ��________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��������Ҫ�ɷ�ΪFeS2���ǹ�ҵ��ȡ�������Ҫԭ�ϣ���ȼ�ղ���ΪSO2��Fe2O3��
��1����֪1g FeS2��ȫȼ�շų�7.1kJ���������ʾFeS2��ȫȼ�շ�Ӧ���Ȼ�ѧ����ʽΪ��
______________________________________________________________��
��2����0.050molSO2(g)��0.030molO2(g)�����ݻ�Ϊ1L���ܱ������У���Ӧ��2SO2(g)��O2(g)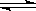 2SO3(g) ��һ�������´ﵽƽ�⣬���c(SO3)=0.040mol/L����������·�Ӧ��ƽ�ⳣ��K����ֵΪ___________,SO2��ƽ��ת����Ϊ__________��
2SO3(g) ��һ�������´ﵽƽ�⣬���c(SO3)=0.040mol/L����������·�Ӧ��ƽ�ⳣ��K����ֵΪ___________,SO2��ƽ��ת����Ϊ__________��
��3�����÷�Ӧ����ƽ��״̬ʱ����ʹƽ��������Ӧ�����ƶ��ҷ�Ӧ���ʼӿ죬���д�ʩ���е��� ��������ĸ��
| A����ƽ�������г���Ar | B����ƽ�������г���O2 |
| C���ı䷴Ӧ�Ĵ��� | D�����ͷ�Ӧ���¶� |
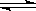 2SO3(g) ��H<0 �� SO2��ת��������ʼ�¶�T1=673K���淴Ӧʱ�䣨t���ı仯����ͼ�������������䣬���ı���ʼ�¶�ΪT2=723K������ͼ�л����¶�T2��SO2��ת�����淴Ӧʱ��仯��Ԥ�ڽ��ʾ��ͼ��
2SO3(g) ��H<0 �� SO2��ת��������ʼ�¶�T1=673K���淴Ӧʱ�䣨t���ı仯����ͼ�������������䣬���ı���ʼ�¶�ΪT2=723K������ͼ�л����¶�T2��SO2��ת�����淴Ӧʱ��仯��Ԥ�ڽ��ʾ��ͼ��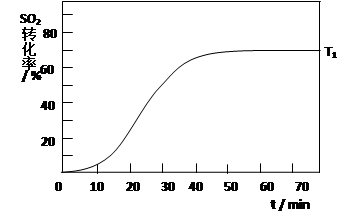
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪��H+(aq)+OH-(aq)= H2O(l) ��H="-57.3" kJ/ mol�����������кͷ�Ӧ�зų���������
��1����20 g NaOH��ɵ�ϡ��Һ��������ϡ���ᷴӦ���ܷų� kJ��������
��2����0.1 mol Ba(OH)2��ɵ�ϡ��Һ��������ϡ���ᷴӦ���ܷų� kJ��������
��3����1 mol����ϡ��Һ������NaOHϡ��Һ��Ӧ���ų������� ������ڡ�����С�ڡ����ڡ���57.3 kJ�������� ��
��4��1 L 0.1 mol/L NaOH��Һ�ֱ���ٴ�����Һ����Ũ���ᡢ��ϡ����ǡ�÷�Ӧʱ���ų��������ֱ�ΪQ1��Q2��Q3����λ��kJ�����������ɴ���С��˳��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��15�֣�A��B��C��D��E��F����ѧ��ѧ�г��������ֶ�����Ԫ�أ��й�λ�ü���Ϣ���£�A������������Ӧ��ˮ���������⻯�ﷴӦ�������ӻ����C����һ�㱣����ú���У�F������������Ӧ��ˮ����������ᷴӦ������Ӧ��G�������ճ��������������Ľ������ױ���ʴ������ش��������⣺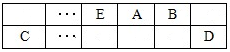
��1��AԪ�ص��⻯��ˮ��Һ��ʹ��̪����ԭ���õ��뷽��ʽ����Ϊ ��
��2��ͬ��ͬѹ�£���a L A�⻯��������b L D���⻯������ͨ��ˮ�У���������Һ��pH=7����a b(�>"��<����=��)
��3�������£���ͬŨ��F��G�����ӵ���Һ�еμ�NaOH��Һ��F��G��Ԫ���Ⱥ������F (OH)n��ȫ������pH��4.7��G (OH)n��ȫ������pH��2.8����ksp�ϴ���ǣ� ���ѧʽ��
��4��A��B�����������Ϊ7:16����ԭ�ӷ��ӣ��÷����ͷ��ڿ������仯ѧ���ÿ��������ĺ���У� ��
������ ������ЧӦ �۹⻯ѧ���� �ܳ������ƻ�
��5��A��C��ɵ�һ�����ӻ��������ˮ��Ӧ�������ּ�÷�Ӧ�Ļ�ѧ����ʽ�� ��
��6����֪һ������E��������B2 (g)��ȼ�գ�����ܵIJ��P������ϵ������ͼ��ʾ����д��һ��������EB2(g) ��E��s����Ӧ����EB(g)���Ȼ�ѧ����ʽ ��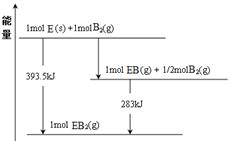
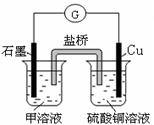
��7������D��G��ɵ�ij�ֻ��������Һ���У�����ͭƬ����Һ��������Ϊ��ɫ�����ݲ���������ķ�Ӧԭ��������Ƶ�ԭ���������ͼ��ʾ���䷴Ӧ��������ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��14�֣�
��п�̷ϵ���е�̼������̼�ۡ�Fe��Cu��Ag��MnO2������ ��Ϊԭ�ϻ���MnO2�Ĺ����������£�
I. ��̼�������ʺ�ɣ�������ϡHNO3�ܽ�������ʣ����ˣ�������a��
II. ������a�ڿ��������ճ�ȥ̼�ۣ��õ���MnO2��
III.���MnO2�м�������H2O2��Һ��MnO2�ܽ�����Mn2+�����������ɣ�
IV. ��III������Һ��pHԼΪ6���л����μ�0.50 mol?L-1 Na2CO3��Һ�����ˣ�������b������Ҫ�ɷ�ΪMnCO3��
V. ����b��ϴ�ӡ�������գ��Ƶýϴ���MnO2��
��1������Ag������ϡHNO3��Ӧ����NO�Ļ�ѧ����ʽΪ ��
��2����֪II�����չ�����ͬʱ������Ӧ��
MnO2(s) + C(s) ="==" MnO(s) + CO (g) ��H = +24.4kJ ? mol �C1 ��
MnO2(s) + CO(g) ="==" MnO(s) + CO2(g) ��H = -148.1 kJ ? mol �C1 ��
д��MnO2��C��Ӧ����MnO��CO2���Ȼ�ѧ����ʽ�� ��
��3��H2O2�����к��еĻ�ѧ������Ϊ �� ��
��4��III��MnO2�ܽ�����ӷ���ʽΪ ���ܽ�һ������MnO2��H2O2��ʵ��������������ֵ�ߣ��û�ѧ����ʽ����ԭ�� ��
��5��IV�У�����Ϊ����0.50 mol?L-1 Na2CO3��Һ�л����μ�III������Һ��������b�л���н϶�Mn(OH)2������������ԭ�� ��
��6��V��MnCO3�ڿ��������յĻ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
����һ���������ɫ�����Դ����������ȡ�봢��������Դ����������о��ȵ㡣����FeO/Fe3O4ѭ�����⣬��֪��
H2O(g)+3FeO(s) Fe3O4(s)+4H2(g) ��H=akJ/mol ��I��
Fe3O4(s)+4H2(g) ��H=akJ/mol ��I��
2Fe3O4(s) 6FeO(s)+O2(g) ��H=bkJ/mol ��II��
6FeO(s)+O2(g) ��H=bkJ/mol ��II��
��������ͼ�ֱ��ʾFeO��ת���ʣ�ͼ-1 )��һ���¶�ʱ��H2����������[ϸ����(ֱ��0.25 mm)���ֿ���(ֱ��3 mm)](ͼ-2)��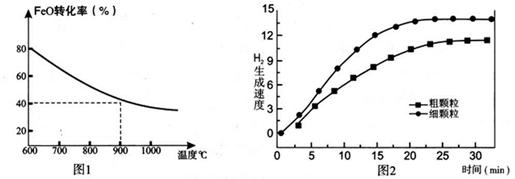
��1����Ӧ��2H2O(g)=2H2(g)+O2(g) ��H= (�ú�a��b����ʽ��ʾ)��
��2��������Ӧb��0��Ҫʹ�����ⷽ����ʵ�����壬����Դ���ü��ɱ��ĽǶȿ��ǣ�ʵ�ַ�ӦII�ɲ��õķ����ǣ� ��
��3��900��Cʱ�������������Ϊ2.0L�ܱ������зֱ�Ͷ��0.60molFeO��0.20mol H2O(g)��������ϸ����FeO���������ôֿ���FeO��
����ϸ����FeO�ʹֿ���FeOʱ��H2�������ʲ�ͬ��ԭ���ǣ� ��
��ϸ����FeOʱH2O(g)��ת���ʱ��ôֿ���FeOʱH2O(g)��ת���� �����С������ȡ�����
������¶��¸÷�Ӧ��ƽ�ⳣ��K��д��������̣�������λ��Ч���֣���
��4������������ͼ3�л�����1000��C����ϸ����FeOʱ��H2O(g)ת������ʱ��仯ʾ��ͼ��������Ӧ�ı�ע����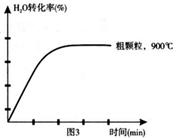
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com