
【题目】一定温度下,一固定体积的密闭容器中发生反应:A(s)+3B(g)![]() 2C(g)+D(g),下列描述中不能说明该反应到达平衡状态的是
2C(g)+D(g),下列描述中不能说明该反应到达平衡状态的是
①混合气体的压强不再变化
②单位时间内生成2a mol C,同时生成3a mol B
③气体密度不再变化
④A的质量不再变化
⑤气体的平均相对分子质量不再变化
⑥2v逆(C)=3v正(B)
A.①③B.②⑤C.①⑥D.④⑤
【答案】C
【解析】
根据化学平衡状态的特征解答,当反应达到平衡状态时,正、逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
①该反应是反应前后气体体积不变的反应,无论反应是否达到平衡状态,气体的物质的量不变,则混合气体的压强不再变化,因此不能据此判断反应是否达到平衡状态,①符合题意;
②单位时间内生成2amol C,就会消耗3amolB,并且同时生成3amol B,说明B物质的物质的量浓度不变,反应处于平衡状态,②不符合题意;
③若反应未达到平衡状态,气体的质量就会发生变化,气体的密度也会变化,若气体密度不再变化,说明反应处于平衡状态,③不符合题意;
④A的质量不再变化,说明A消耗质量与产生的质量不再发生变化,反应处于平衡状态,④不符合题意;
⑤反应物A状态是固体,若未达到平衡,则气体的质量就会改变。若气体的质量不变,反应达到平衡,由于反应前后气体的物质的量不变,则此时气体的平均相对分子质量不再变化 ,可以证明反应处于平衡状态,⑤不符合题意;
⑥在任何条件下, 2v正(B)=3v正(C),若2v逆(C)=3v正(B),则3v正(B)=![]() v正(C)=2v逆(C),9 v正(C)=4v逆(C),反应逆向进行,未达到平衡状态,⑥符合题意;
v正(C)=2v逆(C),9 v正(C)=4v逆(C),反应逆向进行,未达到平衡状态,⑥符合题意;
综上所述可知:①⑥符合题意,故合理选项是C。


科目:高中化学 来源: 题型:
【题目】某矿石主要成分有磁铁矿(Fe3O4)、锰矿(MnO2和MnCO3)、氧化铝(Al2O3)、石棉Mg3Si3O7(OH)4等。其中锰矿含量大于磁铁矿含量。工业上将该矿石处理后提取铝的工业流程如下:
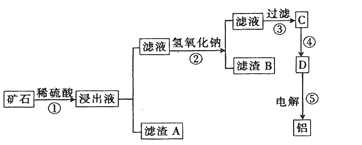
已知:二氧化锰难溶于水、稀硫酸,溶于热浓盐酸。碳酸锰不溶于水,溶于稀硫酸。
(1)MnO2和MnCO3中,Mn元素的化合价分别是_________。
(2)石棉化学式为Mg3Si3O7(OH)4,它与硫酸反应的化学方程式为_________。
(3)滤渣A为____________(填化学式)
(4)步骤②中加入氢氧化钠的作用是_________。
(5)已知不同金属离子生成氢氧化物沉淀所需的pH如表:
离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ | Mn2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 9.3 | 7.8 |
完全沉淀的pH | 3.7 | 4.7 | 9.6 | 10.8 | 9.8 |
步骤②中加入氢氧化钠调节溶液的pH等于11,则滤渣B的成份是________。
(6)步骤③是往滤液中加入一种物质后过滤,这种物质是__________,过滤操作中使用的玻璃仪器有漏斗、_________;由D电解制备铝的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秸秆(含多糖类物质)的综合利用具有重要的意义。下面是以秸秆为原料合成聚酯类高分子化合物的路线:
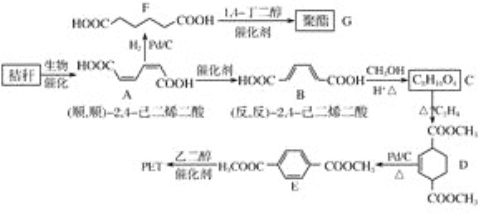
回答下列问题:
(1)下列关于糖类的说法正确的是___。(填标号)
a.糖类都有甜味,具有CnH2mOm的通式
b.麦芽糖水解生成互为同分异构体的葡萄糖和果糖
c.用银镜反应不能判断淀粉水解是否完全
d.淀粉和纤维素都属于多糖类天然高分子化合物
(2)B生成C的反应类型为___。
(3)D中的官能团名称为___,D生成E的反应类型为___。
(4)F 的化学名称是___,由F生成G的化学方程式为____。
(5)具有一种官能团的二取代芳香化合物W是E的同分异构体,0.5molW与足量碳酸氢钠溶液反应生成44gCO2,W共有____种(不含立体异构),其中核磁共振氢谱为三组峰的结构简式为____。
(6)参照上述合成路线,以(反,反)2,4己二烯和C2H4为原料(无机试剂任选),设计制备对苯二甲酸的合成路线____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是________(填序号)。
A.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
B.大力开采煤、石油和天然气以满足人们日益增长的能源需求
C.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
D.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,氧气充足时燃烧生成二氧化碳,反应中放出的热量如图所示。
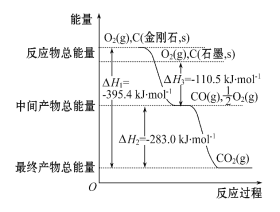
①在通常状况下,________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为ΔH= ____________。
②12 g石墨在24 g氧气中燃烧,生成气体36 g,该过程放出的热量为________。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。
N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ·mol-1。
NO分子中化学键的键能为________kJ·mol-1。
(4)综合上述有关信息,请写出CO和NO反应的热化学方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学用如下图所示装置研究有关电化学的问题。当闭合K时,观察到电流表的指针发生了偏移。
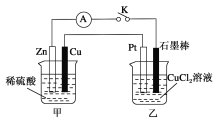
请回答下列问题:
(1)乙装置的名称是________;Zn为________极。
(2)写出电极反应:Cu极:______________________;石墨棒极:______________________。
(3)当甲中产生0.1mol气体时,乙中产生的气体在标准状况下的体积应为________________。
(4)若乙中溶液不变,将其电极都换成铜电极,闭合K一段时间后,乙中溶液的颜色________(填“变深”、“变浅”或“无变化”)。
(5)若乙中电极不变,将其溶液换成NaCl溶液,闭合K一段时间后,甲中溶液的pH将________(填“增大”、“减小”或“不变”,下同);乙中溶液的pH将________。
(6)若乙中电极不变,将其溶液换成饱和Na2SO4溶液,闭合K一段时间,当阴极上有a mol气体生成时,同时有w g Na2SO4·10H2O析出,假设温度不变,剩余溶液中溶质的质量分数应为________(用含w、a的表达式表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NO2装入带有活塞的密闭容器中,当反应2NO2(g)![]() N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
A. 升高温度,气体颜色加深,则此反应为吸热反应
B. 慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅
C. 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D. 恒温恒容时,充入稀有气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解; ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。
①仪器m的名称为___,装置F中试剂的作用是___。
②装置连接顺序:A→___→E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是___。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和___。
(2)①S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式___。
②甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH 溶液,该方案___(填“可行”或“不可行”),原因是___。
(3)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如下实验方案:
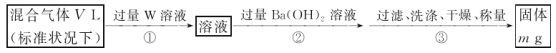
①W溶液可以是___(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中气体X的体积分数为____(用含V、m的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
①室温下,向AgCl浊液中加入少量NaCl饱和溶液,则c(Ag+)、Ksp(AgCl)均减小
②在![]() =1012溶液中 Na+、I-、NO3-、SO42-不能大量共存
=1012溶液中 Na+、I-、NO3-、SO42-不能大量共存
③在原电池装置中,电子从负极流出,沿导线流入正极,经溶液或盐桥回到负极
④锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去
⑤高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”
⑥用0.1 mol/LCH3COOH溶液滴定0.1 mol/LNaOH溶液至中性时:c(CH3COO-)+c(CH3COOH)>c(Na+)
⑦100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性
⑧向饱和NaC1溶液中先通入足量CO2,再通入足量NH3,可析出NaHCO3晶体
A.②④⑥B.①②⑦C.①④⑤D.③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______、______。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g,将样品装入石英玻璃管中,再次将装置A称重,记为m2g,按如图连接好装置进行实验。
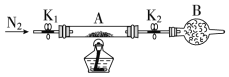
①仪器B的名称是______。
②将下列实验操作步骤正确排序______(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却到室温
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
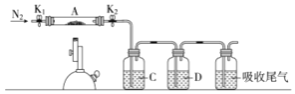
①C、D中的溶液依次为______(填标号)。C、D中有气泡冒出。
A.NaOH B.品红 C.浓H2SO4 D.Ba(NO3)2 E.BaCl2
②写出硫酸亚铁高温分解反应的化学方程式__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com