
| A. | 12.0gNaHSO4晶体中阳离子数为0.2NA个 | |
| B. | 0.1 mol Cu与足量热的浓硫酸反应生成SO2的体积约为22.4 L | |
| C. | T℃时,1L pH=6的纯水中,含1×10-6NA个H+ | |
| D. | 标准状况下,1 L pH=13的NaOH溶液中OH-为0.1NA个 |
分析 A、求出硫酸氢钠的物质的量,然后根据硫酸氢钠晶体由钠离子和硫酸氢根构成来分析;
B、二氧化硫所处的状态不明确;
C、pH=6的纯水中,氢离子浓度为10-6mol/L;
D、pH=13的氢氧化钠溶液中,氢离子浓度为10-13mol/L,而标况下水的离子积不是10-14.
解答 解:A、12g硫酸氢钠的物质的量为0.1mol,而硫酸氢钠晶体由钠离子和硫酸氢根构成,故0.1mol硫酸氢钠晶体中含有阳离子为0.1NA个,故A错误;
B、二氧化硫所处的状态不明确,不一定是标况下,故其体积无法计算,故B错误;
C、pH=6的纯水中,氢离子浓度为10-6mol/L,故1L纯水中氢离子的物质的量为10-6mol,个数为10-6NA个,故C正确;
D、pH=13的氢氧化钠溶液中,氢离子浓度为10-13mol/L,而标况下水的离子积不是10-14,故氢氧根的浓度不是0.1mol/L,个数不是0.1NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意公式的运用和物质的结构特点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 常温下,向0.l mol.L-lNa2A溶液中,不断通入HC1,H2A、HA-、A2-在溶液中所占物质的量分数(δ)与pOH[pOH=-lgc(OH-)]的关系如图所示,下列说法正确的是( )
常温下,向0.l mol.L-lNa2A溶液中,不断通入HC1,H2A、HA-、A2-在溶液中所占物质的量分数(δ)与pOH[pOH=-lgc(OH-)]的关系如图所示,下列说法正确的是( )| A. | H2A的第二级电离平衡常数为l0-l0mol/L | |
| B. | 随着HCl的通入,$\frac{c({H}^{+})}{c({H}_{2}A)}$先减小后增大 | |
| C. | 当溶液呈中性时:c(Na+)═c(HA-)+2c (A2-) | |
| D. | 将等浓度等体积的Na2A与H2A溶液混合后,溶液显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
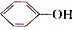 )具有弱酸性,其Ka=1.1×10-l0;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-l0;水杨酸第一级电离形成的离子 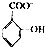 能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是
能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是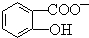 中形成分子内氢键,使其更难电离出H+,故Ka2<Ka.
中形成分子内氢键,使其更难电离出H+,故Ka2<Ka.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.4g H2O2中含有的共用电子对数为0.1NA | |
| B. | 25℃,pH=13的NaOH溶液中,含有OH-的数目为0.1NA | |
| C. | 标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA | |
| D. | 标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
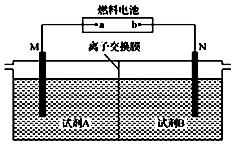 以二甲醚(CH3OCH3)酸性燃料电池为电源,电解饱和食盐水制备氯气和烧碱,设计装置如图所示.已知:a电扱的反应式为O2+4H++4e-═2H2O,下列说法不正确的是( )
以二甲醚(CH3OCH3)酸性燃料电池为电源,电解饱和食盐水制备氯气和烧碱,设计装置如图所示.已知:a电扱的反应式为O2+4H++4e-═2H2O,下列说法不正确的是( )| A. | b电极的反应式为CH3OCH3+3H2O-12e-═2CO2↑+12H+ | |
| B. | 试剂A为饱和食盐水,试刑B为NaOH稀溶液 | |
| C. | 阳极生成1 mol气体时,有1mol离子通过离子交换膜 | |
| D. | 阴极生成1 mol气体时,理论上导线中流过2 mol e- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
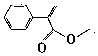 .下列说法正确的是( )
.下列说法正确的是( )| A. | 阿托酸甲酯在碱性条件下易变质 | |
| B. | 阿托酸(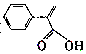 )分子中所有碳原子不可能共平面 )分子中所有碳原子不可能共平面 | |
| C. | 阿托酸甲酯使溴水褪色的反应属于取代反应 | |
| D. | 阿托酸甲酯分子式为C10H8O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液:Na+、K+、MnO4-、SO42- | |
| B. | 0.1mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| C. | 使酚酞变红色的溶液:Na+、Al3+、CO32-、Cl- | |
| D. | 由水电离的c(H+)=1×10-13mol•L-1的溶液:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了防止富脂食品氧化变质,延长食品的保质期,常在包装袋中放入生石灰 | |
| B. | 海水中含有丰富的碘元素,因此碘被称为“海洋元素” | |
| C. | 工业生产玻璃、水泥、漂白粉,均需要用石灰石为原料 | |
| D. | 可以利用氯化铁溶液的酸性清除铜镜表面的铜锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
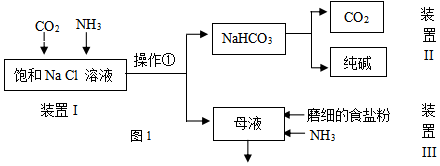
| NaCl | NH4HCO3 | NaHCO3 | NH4Cl | |
| 溶解度(20°C,100gH2O时) | 36.0 | 21.7 | 9.6 | 37.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com