

| 物质名称 | 溶度积(Ksp) | PH值 | |
| 开始沉淀 | 完全沉淀 | ||
| Mg(OH)2 | 5.6×10-12 | 9.3 | 10.8 |
| Fe(OH)3 | 2.8×10-16 | 2.7 | 3.7 |
| Al(OH)3 | 1.3×10-33 | 3.7 | 4.7 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、四种元素形成的简单离子半径按照D、C、B、A的顺序逐渐减小 |
| B、A与其它元素形成的二元化合物的晶体类型相同 |
| C、Z气体通入BaCl2溶液中无现象,再滴入FeCl3溶液则可看到有沉淀产生 |
| D、将Z通入紫色石蕊试液中,试液先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
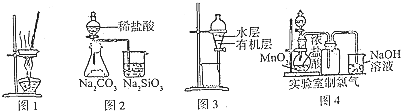
| A、用图l所示装置蒸干AlC13饱和溶液制备AlCl3晶体 |
| B、用图2所示装置证明非金属性Cl>C>Si |
| C、用图3所示装置分离CCl4萃取溴水后已分层的有机层和水层 |
| D、用图4所示装置制取少量Cl2气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com