
 今有正反应放热的可逆反应,若反应开始经t1后达平衡,在t2时由于反应条件改变,使平衡破坏,到t3时又达平衡,如图所示.
今有正反应放热的可逆反应,若反应开始经t1后达平衡,在t2时由于反应条件改变,使平衡破坏,到t3时又达平衡,如图所示.分析 (1)T1℃之前浓度从0渐增大为反应物,反之从非0减小的为生成物,经t1后达平衡;
(2)同一化学反应同一时间段内,各物质浓度的变化量之比等于其计量数之比,反应物生成物最终都不等于0为可逆反应;
(3)从t2秒后X或Y的浓度增大,Z的浓度减小,说明平衡向逆反应方向移动,根据反应的特点和外界条件对平衡的影响来判断.
解答 解:(1)该反应经t1后达平衡,T1℃之前Z的浓度从0渐增大,X或Y的浓度从1.5mol/L减小,所以X、Y为反应物,Z为生成物,
故答案为:X、Y;
(2)该反应达到平衡状态时,X或Y浓度的变化量=(1.5-0.5)mol/L=1mol/L,Z浓度的变化量=(1-0)mol/L=1mol/L,同一化学反应同一时间段内,各物质浓度的变化量之比等于其计量数之比,反应物生成物最终都不等于0为可逆反应,所以该反应方程式为:X+Y?Z,
故答案为:X+Y?Z;
(3)A.t2到t3X或Y的浓度增大,Z的浓度减小,若增大了X或Y的浓度,平衡向正反应方向移动,Z的浓度应增大,不符合,故A错误;
B.使用了催化剂,平衡不移动,X、Y、Z的浓度应不变,故B错误;
C.增大了体系压强,平衡不移动,X、Y、Z的浓度应增大,故C错误;
D.该反应放热,升高该反应的温度,平衡逆向移动,X或Y的浓度增大,Z的浓度减小,图象符合,故D正确.
故选D.
点评 本题考查化学平衡的影响因素,题目难度中等,注意化学方程式的前后计量数的关系以及反应放热的特点,以此判断影响平衡移动的因素.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
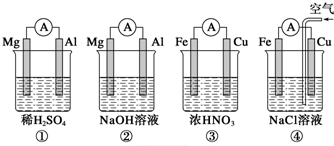
| A. | ①②中Mg作负极,③④中Fe作负极 | |
| B. | ②中Mg作正极,OH-向Al电极移动 | |
| C. | ③中Fe作负极,电极反应式为Fe-2e-=Fe2+ | |
| D. | ④中Cu作正极,电极反应式为2Na++2e-=2Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| B. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| C. | 元素X与氢形成的化合物可能既有极性键又有非极性键 | |
| D. | 元素Z可与元素X形成共价化合物XZ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将pH=10的氨水溶液稀释到原体积的10倍后,溶液的pH=9 | |
| B. | 25℃时,分别向体积均为10mL pH=3的HCl和pH=3的CH3COOH溶液中,滴加0.1mol•L-1的NaOH溶液,至中性时,盐酸消耗的氢氧化钠体积多 | |
| C. | 向0.05mol•L-1的Na2CO3溶液中加入0.05mol CaO,溶液中$\frac{c(O{H}^{-})}{c(HC{{O}_{3}}^{-})}$减小 | |
| D. | 25℃时氯气-氯水体系汇总存在以下平衡关系:c(H+)-c(OH-)=2c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10 | B. | C3H8 | C. | C2H6 | D. | CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b-a=m+n | B. | a+b=m+n | C. | a-b=m-n | D. | a-b=m+n |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
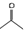 可表示CH3COCH3,则
可表示CH3COCH3,则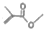 的结构简式:(CH3)2CHCOOCH3
的结构简式:(CH3)2CHCOOCH3 .
.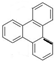 的一氯代物有6种,邻二甲苯苯环上的二氯代物有4种.
的一氯代物有6种,邻二甲苯苯环上的二氯代物有4种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采用“绿色化学”工艺,使原料尽可能转化为所需要的物质 | |
| B. | 减少氟氯烃气体的使用,保护臭氧层免遭破坏 | |
| C. | 大量砍伐树木,制造生活必需品,从而降低物价,维持社会和谐 | |
| D. | 提倡每个人都要有“节能减排”的观念,在生活细节中也要点点滴滴地节约能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com