
| A. | 单甘油酯、混甘油酯、苛性钾、氢硫酸、三氧化硫 | |
| B. | 胆矾、漂白粉、硫酸钠、次氯酸、氨气 | |
| C. | 明矾、水煤气、盐酸.醋酸、铜 | |
| D. | 冰醋酸、福尔马林、硫酸钡、氢硫酸、乙醇 |
分析 纯净物是指由同种物质组成的,混合物是指由不同种物质组成的,
电解质是指在水溶液里或熔化状态下能够导电的化合物,非电解质是指在水溶液里和熔化状态下都不能够导电的化合物,
据此可以分析各个选项中各种物质的所属类别.
解答 解:A.混甘油酯是一种纯净的化合物,故A错误;
B.胆矾是一种物质组成的纯净物、漂白粉是氯化钙和次氯酸钙组成的混合物、硫酸钠水溶液中完全电离属于强电解质、次氯酸水溶液中部分电离属于弱电解质、氨气不能电离属于非电解质,故B正确;
C.元素为氯化氢的水溶液属于混合物,铜是单质既不是电解质也不是非电解质,故C错误;
D.冰醋酸是一种物质组成的纯净物、福尔马林是甲醛的水溶液属于混合物、硫酸钡熔融状态完全电离属于强电解质、氢硫酸水溶液中部分电离属于弱电解质、乙醇不能电离属于非电解质,故D正确,故选BD.
点评 本题考查了纯净物、混合物、电解质、非电解质的概念判断及各种物质的成分掌握,题目难度中等.


科目:高中化学 来源: 题型:实验题
 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1,3-丁二烯(CH2=CHCH=CH2)和2-丁炔(CH3C CH3)是重要的有机原料.
1,3-丁二烯(CH2=CHCH=CH2)和2-丁炔(CH3C CH3)是重要的有机原料.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
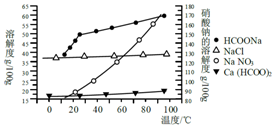 甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.
甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.| 金属 离子 | 开始沉淀 的pH | 沉淀完全 的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜全部溶解,且溶液为蓝色,有红棕色气体产生 | |
| B. | 铜部分溶解,且溶液为蓝色,有红棕色气体产生 | |
| C. | 铜全部溶解,且溶液为蓝色,有无色气体产生 | |
| D. | 铜部分溶解,且溶液为蓝色,有无色气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+在反应①中作氧化剂,在反应②中为氧化产物 | |
| B. | 若生成标准状况下22.4 L O2,则整个过程中转移电子总数为2 mol | |
| C. | 在H2O2分解过程中,溶液的pH逐渐减小 | |
| D. | 在工业生产H2O2过程中要严格避免混入Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “滴水石穿、绳锯木断”不涉及化学变化 | |
| B. | 氟利昂作制冷剂会加剧雾霾天气的形成 | |
| C. | 明矾净水的原理和“84”消毒液消毒的原理不相同 | |
| D. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烟花燃放,五彩缤纷的焰火体现了某些金属元素的物理性质 | |
| B. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关 | |
| C. | 淀粉和纤维素都能水解,水解最终产物都为葡萄糖 | |
| D. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
| 开始沉淀时的pH | 2.7 | 4.0 | 6.4 | 7.7 |
| 完全沉淀时的pH | 3.7 | 5.2 | 8.0 | 10.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com