解答:解:导致酸雨的主要物质是二氧化氮和二氧化硫,且W、X、Y、Z是周期表前36号元素中的四种常见元素,Y的原子序数大于W的,所以W是氮元素,Y是硫元素;X的基态原子核外有7个原子轨道填充了电子,且原子序数大于W小于Y,所以X是铝元素;Z能形成红色(或砖红色)的Z
2O和黑色的ZO两种氧化物,且Z是前36号元素,Z的原子序数大于Y的,所以Z是铜元素.
(1)W是N元素,N原子的原子结构示意图为
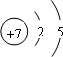
,电子层数等于其周期数,最外层电子数等于其主族序数,所以氮元素属于第二周期第ⅤA族;
气态氢化物的稳定性与元素的非金属性有关系,非金属越强,气态氢化物的稳定性越强,氧元素的非金属性大于氮元素的非金属性,所以水的稳定性大于氨气的稳定性,
故答案为:二;ⅤA;弱;
(2)Y为硫元素,硫原子核外电子数为16,基态核外电子排布式为1s
22s
22p
63s
23p
4,硫为非金属,X为铝元素,非金属的第一电离能高于金属的第一电离能,故Y的第一电离能比X的大;
故答案为:1s
22s
22p
63s
23p
4;大;
(3)浓硫酸和铜在加热条件下能反应生成硫酸铜、水和二氧化硫,方程式为:2H
2SO
4(浓)+Cu
CuSO
4+SO
2↑+2H
2O,
故答案为:2H
2SO
4(浓)+Cu
CuSO
4+SO
2↑+2H
2O;
(4)Fe(s)+
O2(g)=FeO(s)△H=-272.0KJ?mol
-1 ①
2X(s)+
O2(g)=X2O3(s)△H=-1675.7KJ?mol
-1 ②
将方程式×②-①得方程式X的单质和FeO反应的热化学方程式是:Al(S)+FeO(S)+
O
2 (g)=
Al
2O
3(S)+Fe(S)△H=-565.85KJ/mol,
故答案为:Al(S)+FeO(S)+
O
2 (g)=
Al
2O
3(S)+Fe(S)△H=-565.85KJ/mol.

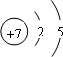 ,电子层数等于其周期数,最外层电子数等于其主族序数,所以氮元素属于第二周期第ⅤA族;
,电子层数等于其周期数,最外层电子数等于其主族序数,所以氮元素属于第二周期第ⅤA族;

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案 (g)===FeO(s) ΔH=-272.0 kJ·mol-1
(g)===FeO(s) ΔH=-272.0 kJ·mol-1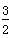 O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1
O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1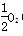 (g)===FeO(s) ΔH=-272.0 kJ·mol-1
(g)===FeO(s) ΔH=-272.0 kJ·mol-1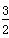 O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1
O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1