
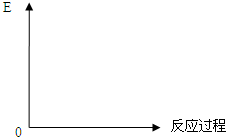
 Ⅰ、试分析比较合成氨与用SO2和O2反应制SO3的反应
Ⅰ、试分析比较合成氨与用SO2和O2反应制SO3的反应分析 (1)工业合成氨气利用的是氢气与氮气反应,此反应属于放热反应、正方向气体体积减小的反应,均不需要高温,据此解答即可;
(2)工业合成氨气,条件为加热,催化剂和高压,二氧化硫合成三氧化硫为:加热、催化剂,且为了增加二氧化硫的转化率需要加入足量的氧气,据此解答即可;
(3)放热反应:生成物的总能量高于生成物的总能量,据此画图即可;
(4)亚硫酸盐容易被空气中的氧气氧化生成硫酸盐,据此解答即可;
(5)生石灰是氧化钙,溶于水放出大量的热,据此解答即可.
解答 解:I(1)工业合成氨气利用的是氢气与氮气反应,此反应属于放热反应、正方向气体体积减小的反应,均不需要高温,故共同点有:①△H<0,②△S<0,③均能在低温下反应,
故答案为:<;<;低温下;
(2)①SO2氧化在常压下,而合成氨需要高压,因常压下SO2转化率已较大,可减少能耗,故答案为:常压下SO2转化率已较大,可减少能耗;
②SO2氧化通常鼓入过量空气,使SO2进一步转化又减少尾气处理的压力;而合成氨N2、H2转化率小,常剩余而循环使用(仅补充原料气),
故答案为:SO2氧化通常鼓入过量空气,使SO2进一步转化又减少尾气处理的压力;而合成氨N2、H2转化率小,常剩余而循环使用;
③SO2氧化的催化剂常是V2O5,它参加反应而催化;合成氨的催化剂是铁触媒,它通过表面吸附而催化,
故答案为:SO2氧化的催化剂常是V2O5,它参加反应而催化;合成氨的催化剂是铁触媒,它通过表面吸附而催化;
(3)放热反应特点:生成物的总能量高于生成物的总能量,故图象为: ,故答案为:
,故答案为: ;
;
(4)亚硫酸盐容易被空气中的氧气氧化生成硫酸盐,故钙基固硫最终产物为硫酸钙,故答案为:硫酸钙;
(5)生石灰是氧化钙,溶于水放出大量的热,故生石灰与水反应生成氢氧化钙时放出热量、又碱性增强,都能促使一水合氨的分解,促进氨气的逸出,故答案为:生石灰与水反应生成氢氧化钙时放出热量、又碱性增强,都能促使一水合氨的分解,促进氨气的逸出.
点评 本题主要考查的是工业合成氨与工业制取三氧化硫的比较,涉及能量变化规律以及氧化还原反应,有一定难度.


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:选择题
 实验室中部分气体的制取及性质实验装置如图所示(省略加持和净化装置)对c中现象判断正确的是( )
实验室中部分气体的制取及性质实验装置如图所示(省略加持和净化装置)对c中现象判断正确的是( )| 选项 | 试剂a | 试剂b | 试剂c | c中的现象 |
| A | 浓氨水 | 生石灰 | 硝酸银溶液 | 先沉淀后消失 |
| B | 稀硝酸 | 银 | 水 | 试管口无明显现象 |
| C | 浓盐酸 | 高锰酸钾 | 石蕊溶液 | 溶液颜色没有变化 |
| D | 稀硫酸 | 纯碱 | 硅酸钠溶液 | 先沉淀后消失 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
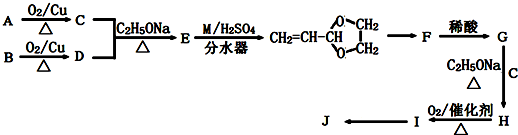
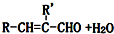

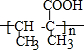 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )与苯环性质相似.有机物M与磷酸在一定条件下形成磷酸吡醛,磷酸吡醛是细胞的重要组成部分.下列说法不正确的是( )
)与苯环性质相似.有机物M与磷酸在一定条件下形成磷酸吡醛,磷酸吡醛是细胞的重要组成部分.下列说法不正确的是( )
| A. | M能使酸性高锰酸钾溶液褪色 | |
| B. | 1 mol磷酸吡醛与足量的金属钠反应,最多消耗2mol Na | |
| C. | 1 mol磷酸吡醛与NaOH溶液反应,最多消耗4mol NaOH | |
| D. | M与足量H2反应后所得有机物的分子式为C8H17O3N |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3 | B. | 3:1 | C. | 2:1 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | HF | H2CO3 | HClO |
| 电离平衡常数(Ka) | 7.2×10-4 | Kal=4.4×10-7 Ka2=4.7×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是甲醛 | B. | 可能是乙醛 | ||
| C. | 混合物中二者的质量比是1:3 | D. | 不可能有此种醛 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com