
| A. | 加入氢氧化钠固体 | B. | 加水 | ||
| C. | 通入二氧化碳气体 | D. | 加入饱和石灰水溶液 |
分析 碳酸氢钠溶于水电离出碳酸氢根离子,碳酸氢根离子能电离出氢离子和碳酸根离子,且存在电离平衡,HCO3-?H++CO32-,只要加入的物质和氢离子、碳酸根离子都反应,使平衡向正反应方向移动即可.
解答 解:A.NaHCO3+NaOH=Na2CO3+H2O,所以加入氢氧化钠固体后,碳酸氢根离子浓度减小,碳酸根离子浓度增大,氢离子浓度减小,故A错误;
B.加水稀释促进水解氢氧根离子的浓度减小,氢离子浓度增大,故B错误;
C.CO2与水反应生成碳酸,c(H+)、c(HCO3-)增大,故C错误;
D.Ca(OH)2+NaHCO3=CaCO3↓+H2O+NaOH,所以加入饱和石灰水溶液后,碳酸氢根离子转化为碳酸钙沉淀,所以碳酸氢根离子浓度、碳酸根离子浓度都减小,溶液由弱碱性变为强碱性,所以氢离子浓度也减小,故D正确.
故选D.
点评 本题考查了弱电解质的电离平衡以及盐类水解知识,侧重于学生的分析能力的考查,难度不大,根据平衡移动原理分析是解本题的关键.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焓变和熵变都与反应的自发性有关,又都不能独立地作为自发性的判据 | |
| B. | -10℃的液态水就会自动结冰成为固态,因为这是熵增的过程 | |
| C. | 大量事实告诉我们,过程的自发性只能用于判断过程的方向,不能确定过程是否一定会发生和过程发生的速率 | |
| D. | 放热反应过程中体系能量降低,因此有自发进行的倾向,但是有些吸热反应也可以自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | 20℃ | 60℃ | 100℃ |
| Na2Cr2O7 | 73.2 | 82.0 | 91.4 |
| K2Cr2O7 | 13.1 | 50.5 | 96.2 |
| NaCl | 36 | 37 | 39 |
| KCl | 34 | 45.5 | 56.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、C1-、NO3-、H+ | B. | K+、Cl-、SO42-、H | ||
| C. | Fe3+、C1-、SO42-、NH4+ | D. | Ca2+、HCO3-、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl、KOH、K2CO3、KHCO3 | B. | K2CO3、KOH、K2O2、KHCO3 | ||
| C. | K2SO3、KOH、K2O2、KHCO3 | D. | KHCO3、KOH、K2O2、K2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用电解饱和MgCl2溶液的方法获得金属镁 | |
| B. | 电解法精炼粗铜,用粗铜作阳极,纯铜作阴极 | |
| C. | 电解熔融Al2O3制备金属铝时,加入冰晶石使Al2O3更易熔化 | |
| D. | 氯碱工业中电解食盐水时,阳离子交换膜可防止氯气与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
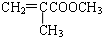 )是生产有机玻璃的单体.
)是生产有机玻璃的单体. .
. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$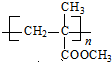 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com