
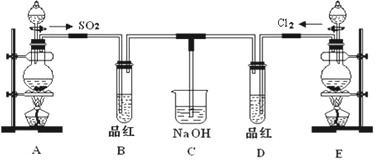
分析 A用于制备SO2,可用Na2SO3与硫酸反应制取,B用于检验二氧化硫的生成,E用浓盐酸和二氧化锰在加热条件下制备氯气,D用于检验气体的漂白性,C用于吸收尾气.
(1)使用分液漏斗时应取下塞子,使分液漏斗内的压强等于大气压强,保证液体顺利流出;
(2)实验室用装置E制备Cl2,需加热,为二氧化锰和浓盐酸的反应,二氧化锰与浓盐酸在加热条件下反应生成氯气和氯化锰、水;生成1mol氯气,消耗4mol氯化氢,2mol氯化氢显酸性,2mol氯化氢显还原性被氧化;
(3)SO2的漂白具有可逆性,次氯酸的漂白不可逆;
(4)氯气具有较强的氧化性,二氧化硫具有较强的还原性,二氧化硫与氯气等物质的量反应生成盐酸和硫酸,盐酸和硫酸都不具有漂白性.
解答 解:(1)塞子没有取下来,打开活塞时,空气无法进入分液漏斗内部,造成分液漏斗内的压强小于大气压强,液体无法流出,使用分液漏斗时应取下塞子,使分液漏斗内的压强等于大气压强,保证液体顺利流出,
故答案为:分液漏斗的玻璃塞没有取下来;
(2)实验室用装置E制备Cl2,需加热,为二氧化锰和浓盐酸的反应生成氯气,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,离子反应为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑,氯化氢在反应中既表现酸性又表现还原性,4mol氯化氢参加反应,表现为酸性的占$\frac{1}{2}$,若在标准状态下收集到22.4升的氯气,物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,依据方程式可知参加反应的盐酸有4mol,被氧化的氯化氢为2mol,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑;2mol;
(3)次氯酸的漂白性是永久性的,具有不可逆性,二氧化硫的漂白性是暂时的,加热时,次氯酸漂白过的溶液无变化,二氧化硫和有色物质生成的无色物质不稳定,加热时会变成红色,所以B褪色的品红又恢复成红色,D无明显现象,
故答案为:褪色的品红又恢复成红色;无明显现象;SO2漂白后的物质具有不稳定性,加热时又变成红色,而氯气的漂白具有不可逆性;
(4)二氧化硫与氯气等物质的量反应生成盐酸和硫酸,盐酸和硫酸都不具有漂白性,化学方程式为:SO2+Cl2+2H2O=H2SO4+2HCl;
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl.
点评 本题考查氯气和二氧化硫的漂白性质,题目难度中等,注意掌握氯气和二氧化硫性质,明确二氧化硫的漂白性与次氯酸的漂白性根本区别.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)→2H2O(l)+Q1 2H2(g)+O2(g)→2H2O(g)+Q2 | |
| B. | S(g)+O2(g)→SO2(g)+Q1 S(s)+O2(g)→SO2(g)+Q2 | |
| C. | C(s)+0.5O2(g)→CO(g)+Q1 C(s)+O2(g)→CO2(g)+Q2 | |
| D. | H2(g)+Cl2(g)→2HCl(g)+Q1 $\frac{1}{2}{H_2}$(g)+$\frac{1}{2}C{l_2}$(g)→HCl(g)+Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl- | |
| B. | 含有大量OH-的溶液:Na+、Ca2+、SO42-、CO32- | |
| C. | 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- | |
| D. | 含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l);△H=-57.4kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 | |
| C. | 已知反应2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ•mol-1,则H2的燃烧热为571.6kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制过程只需要三种仪器即可完成 | |
| B. | 容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制 | |
| C. | 所配得的NaClO消毒液物质的量浓度为3.99mol/L | |
| D. | 需要称量的NaClO固体的质量为140g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1Ll.00mol•L-1NaCl溶浓中NaCl分子数为NA | |
| B. | 标准状况下,2.24L由N2和O2组成的混合气体中所含的原子数为0.1NA | |
| C. | 常温下,0.1molCl2溶于水时,转移的电子效是0.1NA | |
| D. | 0.lmolFe与过量稀HNO3反应时,转移的电子教为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35Cl-和37Cl-离子结构示意图均可以表示为: | |
| B. | HClO的结构式:H-Cl-O | |
| C. | HF的电子式: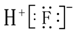 | |
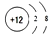
| D. | 质子数为92、中子数为146的U原子:14692U |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com