
【题目】“钙基固硫”是将煤中的硫元素以CaSO4的形式固定脱硫,而煤炭燃烧过程中产生的CO又会发生反应I和反应II,导致脱硫效率降低。某温度下,反应I的速率(v1)大于反应II的速率(v2),则下列反应过程能量变化示意图正确的是
反应I:CaSO4(s)+CO(g) ![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4kJ·mol-1
CaO(s)+SO2(g)+CO2(g) △H1=+218.4kJ·mol-1
反应II:CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g) △H2=-175.6kJ·mol-1
CaS(s)+4CO2(g) △H2=-175.6kJ·mol-1

A. A B. B C. C D. D
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】有未知浓度的Ba(OH)2和NaOH混合溶液,量取四份该溶液分别通入等量的CO2(已折算成标准状况下的体积,不考虑CO2在水中的溶解),生成沉淀的物质的量如下表:
实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
CO2体积(mL) | 2352 | 2352 | 2352 | 2352 |
样品体积(mL) | 20.0 | 30.0 | 40.0 | 50.0 |
沉淀物质的量(×10-2mol) | 1.50 | 4.50 | 6.00 | 7.50 |
(1)该混合溶液中Ba(OH)2的物质的量浓度=_____________。
(2)实验Ⅲ最后所得溶液中碳酸钠的物质的量=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一恒温、恒容的密闭容器中发生反应:3H2(g)+N2(g)![]() 2NH3(g) ΔH<0。t1时刻反应达到平衡,在t2时刻改变某一条件,其反应过程如图所示。下列说法正确的是
2NH3(g) ΔH<0。t1时刻反应达到平衡,在t2时刻改变某一条件,其反应过程如图所示。下列说法正确的是

A. Ⅰ、Ⅱ两过程达到平衡时,平衡常数:KⅠ<KⅡ
B. Ⅰ、Ⅱ两过程达到平衡时,NH3的体积分数:Ⅰ<Ⅱ
C. Ⅰ、Ⅱ两过程达到平衡的标志:气体的平均密度不再发生变化
D. t2时刻改变的条件可以是向密闭容器中加H2和N2的混合气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g) ![]() a Z(g)+W(g) ΔH=-Q kJ·mol-1(Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
a Z(g)+W(g) ΔH=-Q kJ·mol-1(Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值是____________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为____________。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?________,其理由是___________________。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是____________(稀有气体不参与反应)。
A.2 mol X、1 mol Y、1 mol Ar
B.a mol Z、1 mol W
C.1 mol X、0.5 mol Y、0.5a mol Z、0.5 mol W
D.2 mol X、1 mol Y、1 mol Z
(5)X的转化率α=____________(用含Q、Q1的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化在给定条件下每一步都能实现的是
A. Si![]() SiO2
SiO2![]() H2SiO3
H2SiO3
B. Mg(OH)2![]() MgCl2(aq)
MgCl2(aq) ![]() Mg
Mg
C. Al2O3![]() A1Cl3(aq)
A1Cl3(aq) ![]() 无水AlCl3
无水AlCl3
D. CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH3
CH3COOCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.碳﹣12 原子和碳﹣13 原子的中子数相同
B.KMnO4 和 K2 MnO4 中有相同的原子团
C.Fe2+和 Fe3+都属于铁元素,核外电子数不同
D. 和
和 化学性质相似
化学性质相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅石(主要成分SiO2)为起始原料生产高纯多晶硅的简化工艺流程如下图所示:
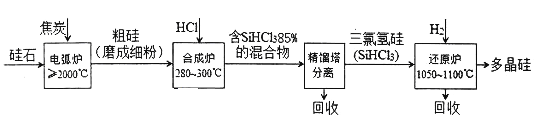
(1)在电弧炉中,生成粗硅的化学方程式为____________,该反应氧化剂与还原剂物质的量之比为_____________。
(2)合成炉中有关反应的数据如下表所示:
热化学方程式 | 平衡常数 | |
主反应 | Si(s)+3HCl(g) | K1 |
副反应 | Si(s)+4HCl(g) | K2 |
①主反应的温度需严格控制在280~300℃之间,若温度过低,则__________________;若温度太高,SiHCl3则会转化生成SiCl4,该转化的热化学方程式为_____________________。
②平衡时,![]() 的值a随着
的值a随着![]() 的值b的变化而变化,则
的值b的变化而变化,则![]() =______(用含K1、K2的代数式表示)。工业上用H2适当稀释HCl来提高
=______(用含K1、K2的代数式表示)。工业上用H2适当稀释HCl来提高![]() 的值,请用平衡移动原理加以解释________________________。
的值,请用平衡移动原理加以解释________________________。
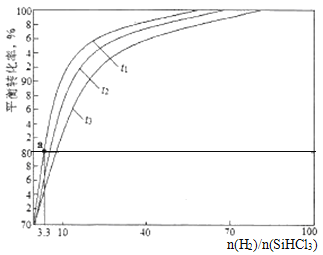
(3)还原炉中的主要反应为SiHCl3(g)+H2(g)=Si(s)+3HCl(g) △H>0。实验室中在1.0L密闭容器中研究得到SiHCl3的转化率在不同温度条件下随n(H2)/(SiHCl3)变化的曲线如图所示。t1、t2、t3表示的温度高低顺序为_______;t1温度时平衡常数Ka=______(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一处于平衡状态的反应X(g) +3Y(g)![]() 2Z(g) (正反应是放热反应) 。为了使平衡向生成Z的方向移动, 应选择的条件是
2Z(g) (正反应是放热反应) 。为了使平衡向生成Z的方向移动, 应选择的条件是
①升高温度 ②降低温度 ③增大压强 ④降低压强 ⑤加入正催化剂 ⑥分离出Z
A. ①③⑤ B. ②③⑤ C. ②③⑥ D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯气的说法错误的是( )
A.氯气是黄绿色气体
B.氯气有强烈刺激性气味且有毒
C.氯气能使干燥的有色布条褪色
D.氯气是活泼的非金属单质,具有很强的氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com