
分析 (1)电解质导电的原因:含有自由移动的离子或自由电子;
电解质是在水溶液里或熔融状态下能导电的化合物是电解质,包括酸、碱、盐、活泼金属氧化物和水;
非电解质是在水溶液里和熔融状态下都不能导电的化合物,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等);
(2)铁与盐酸反应生成氯化亚铁和氢气;
氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水;
(3)分析反应中元素化合价变化,所含元素化合价升高的反应物为还原剂,对应产物为氧化产物;所含元素化合价降低的反应物为氧化剂,对应产物为还原产物;依据氧化还原反应得失电子守恒书写方程式,计算转移电子数.
解答 解:(1)①铁单质含有自由电子,能够导电,既不是电解质也不是非电解质;
②石墨属于单质,含有自由电子,能够导电,既不是电解质也不是非电解质;
③氯气 是单质,不含自由移动的离子或自由电子,不导电;既不是电解质也不是非电解质;
④硫酸钡晶体不含自由移动的离子或自由电子,不导电;熔化状态下能够导电的化合物属于电解质;
⑤纯硫酸不含自由移动的离子或自由电子,不导电;水溶液中能够导电的化合物属于电解质;
⑥盐酸含自由移动的离子,能够导电;属于混合物,既不是电解质也不是非电解质;
⑦澄清石灰水含自由移动的离子,能够导电;属于混合物,既不是电解质也不是非电解质;
⑧乙醇不含自由移动的离子或自由电子,不导电;水溶液和熔融状态下都不导电的化合物,是非电解质;
⑨熔化的硝酸钾含自由移动的离子,能够导电;属于电解质;
⑩FeCl2溶液含自由移动的离子,能够导电;是混合物,既不是电解质也不是非电解质;
所以:中能导电的是①②⑥⑦⑨⑩;属于电解质的是④⑤⑨;
故答案为:①②⑥⑦⑨⑩;④⑤⑨;
(2)铁与盐酸反应生成氯化亚铁和氢气,离子方程式:Fe+2H+═Fe2++H2↑,
故答案为:Fe+2H+═Fe2++H2↑;
氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水,离子方程式:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)反应中过氧化氢中-1价的氧化合价降低为-2价,过氧化氢为氧化剂,氯化亚铁中-2价化合价升高为-3价,被氧化对应氯化铁为氧化产物,依据得失电子守恒、原子个数守恒,方程式为:2HCl+1H2O2+2FeCl2=2FeCl3+2H2O,用单线桥表示为: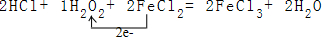 ;
;
依据方程式可知生成2mol水即36g水转移电子数为2mol,则生成9g水转移电子数为0.5mol;
故答案为: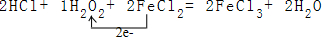 ;负1价氧;FeCl3(Fe3+);0.5;
;负1价氧;FeCl3(Fe3+);0.5;
点评 本题考查了电解质的判断及离子方程式的书写、氧化还原反应方程式配平及有关电子转移的计算,题目难度不大,注意单质、混合物既不是电解质也不是非电解质.


科目:高中化学 来源: 题型:选择题
| A. | 7种和2种 | B. | 8种和3种 | C. | 42种和3种 | D. | 56种和3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
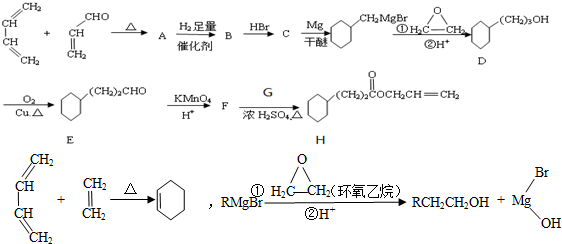
 ,G物质核磁共振氢谱共有4个峰.
,G物质核磁共振氢谱共有4个峰. .写出D生成E的化学方程式
.写出D生成E的化学方程式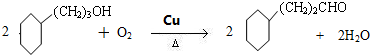 .
.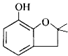 呋喃酚是一种合成农药的重要中间体,它的同分异构体很多,写出符合下列条件的所有芳香族同分异构体的结构简式:
呋喃酚是一种合成农药的重要中间体,它的同分异构体很多,写出符合下列条件的所有芳香族同分异构体的结构简式: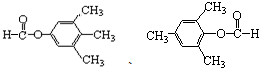 .
.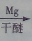 CH3CH2MgBr
CH3CH2MgBr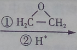 CH3CH2CH2CH2OH.
CH3CH2CH2CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (NH4)2CO3+H2SO4═(NH4)2SO4+H2O+CO2↑ | |
| B. | NaHCO3+HNO3═NaNO3+H2O+CO2↑ | |
| C. | Na2CO3+2CH3COOH═2CH3COONa+H2O+CO2↑ | |
| D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硫化亚铁溶于足量稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | 石灰石溶于醋酸:CaCO3+2CH3COOH═2CH3COO-+Ca2++CO2↑+H2O | |
| C. | FeCl2溶液中通入少量氯气:Fe2++Cl2═Fe3++2Cl- | |
| D. | 硫酸亚铁溶液中滴加酸化的双氧水:2Fe2++2H++H2O2═2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
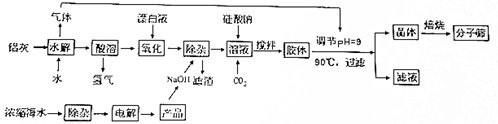
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 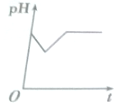 | B. | 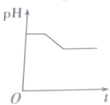 | C. | 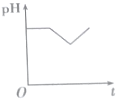 | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com