
|
已知:2Fe3++Cu→Cu2++2Fe2+.现有含有Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液,且Fe与稀硝酸反应的还原产物仅为NO.若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间关系如下图所示.则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为
| |
| [ ] | |
A. |
1︰1︰1 |
B. |
1︰3︰1 |
C. |
3︰3︰8 |
D. |
1︰1︰4 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
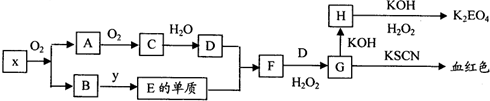
查看答案和解析>>
科目:高中化学 来源: 题型:
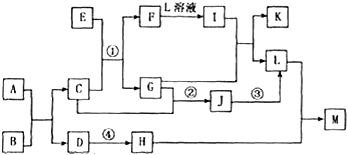
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| Cu2O |
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |

查看答案和解析>>
科目:高中化学 来源: 题型:
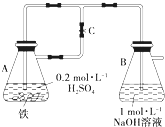 (1)如下图所示,当容器A中的反应开始后,若分别进行下列操作,请回答有关问题:
(1)如下图所示,当容器A中的反应开始后,若分别进行下列操作,请回答有关问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com