
在指定溶液中一定能大量共存的离子组是
A.1.0mol·L-1KNO3溶液:H+、Fe2+、Cl-、SO42-
B.pH=1的溶液:NH4+、Al3+、SO42-、Br-
C.c(ClO-)=1.0mol·L-1的溶液:Na+、SO32-、S2-、Cl-
D.与铝反应产生H2的溶液中:Na+、Mg2+、HCO3-、SO42-
科目:高中化学 来源: 题型:
将相同质量的铜分别与过量浓硝酸、稀硝酸反应,下列叙述正确的是( )
A.反应速率:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化合物的俗称与化学式不对应的是
A.绿矾-FeSO4·7H2O B.芒硝-Na2SO4·10H2O
C.明矾- Al2(SO4)3·12H2O D.胆矾- CuSO4·5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
锌与不同浓度的硝酸可发生不同的反应(y表示耗去Zn的物质的量,x表示被还原的硝酸的物质的量),
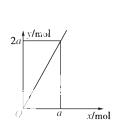 其中参加反应的锌与被还原的硝酸的物质的量的关系符合右图的是
其中参加反应的锌与被还原的硝酸的物质的量的关系符合右图的是
A.3Zn+8HNO3(稀)===3Zn(NO3)2+4H2O+2NO↑
B.4Zn+10HNO3(极稀)=== 4Zn(NO3)2+5H2O+N2O↑
C.4Zn+10HNO3极稀=== 4Zn(NO3)2+3H2O+NH4NO3
D.Zn+4HNO3(浓)===Zn(NO3)2+2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向鸡蛋白溶液中滴入HgCl2溶液 | 有白色沉淀 | 蛋白质发生盐析 |
| B | 向溶液X中滴加BaCl2溶液 | 有白色沉淀 | X中一定含有SO42- |
| C | AgCl饱和溶液中加入少量NaI溶液 | 产生黄色沉淀 | Ksp(AgI)>Ksp(AgCl) |
| D | 向加入了几滴酚酞试液的Na2CO3溶液中滴加BaCl2溶液 | 红色逐渐退去 | Na2CO3溶液中存在水解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。
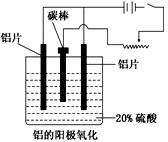 (1)工业上采用电解氧化铝和冰晶石(Na3AlF6)熔融体的
(1)工业上采用电解氧化铝和冰晶石(Na3AlF6)熔融体的
方法冶炼得到金属铝:2Al2O3 4Al+3O2↑。
4Al+3O2↑。
加入冰晶石的作用为_______________________。
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,
可用电解方法进一步提纯,该电解池中阳极的电极
反应式为________,下列可作阴极材料的是______。
a.铝材 b.石墨 c.铅板 d.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式为_______________________。在铝阳极氧化过程中,需要不断地调整电压,理由是_________________。
(4)下列说法正确的是__________________。
a.阳极氧化是应用原电池原理进行金属材料表面处理的技术
b.铝的阳极氧化可增强铝表面的绝缘性能
c.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
d.铝的阳极氧化膜富多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液可能含有Na+、Fe3+、Br﹣、I﹣、HCO3﹣、SO32﹣、NO3﹣等离子①向该溶液中滴加氯水,无气泡产生,溶液呈橙色;②向橙色溶液中加入BaCl2溶液产生白色沉淀;③向橙色溶液中滴加淀粉溶液未变蓝,则在该溶液中肯定存在的离子组是
A.Na+、I﹣、SO32﹣ B.Na+、Br﹣、SO32﹣
C.Fe3+、Br﹣、NO3﹣ D.Na+、Br﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的Fe和Fe2O3混合物投入1 mol·L-1 300 mL的HNO3溶液中,反应完全后,无固体剩余,生成1.12 LNO气体(标准状况),再向反应后溶液中加入1 mol·L-1的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是
A.200mL B.245mL C.250mL D.300mL
查看答案和解析>>
科目:高中化学 来源: 题型:
铍(Be)与铝的性质相似,已知反应BeCl2+Na2BeO2+2H2O===2NaCl+2Be(OH)2↓能进行完全。据此作出的以下推断中正确的是( )
A.常温时,BeCl2溶液pH >7,将其蒸干、灼烧后可得残留物BeCl2
B.常温时,Na2BeO2溶液pH<7,将其蒸干、灼烧后可得残留物Na2BeO2
C.BeOH2既能溶于盐酸,又能溶于NaOH溶液
D.BeCl2水溶液的导电性较强,说明BeCl2一定是离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com