
一真空定容的密闭容器中盛有1mol PCl5,发生反应PCl5(g)⇌PCl3(g)+Cl2(g),一定条件下平衡时PCl5所占的体积百分数为M,若相同条件相同容器中,最初放入2mol PCl5,则平衡时,PCl5的体积百分数为N,下列结论正确的是( )
|
| A. | M>N | B. | M=N | C. | M<N | D. | 无法比较 |
考点:
化学平衡的计算.
分析:
加入2molPCl5所到达的平衡,可以等效为先将体积增大1倍到达的平衡状态,该状态与开始加入1molPCl5是完全相同的平衡状态,然后在将体积压缩恢复到原来的体积,增大压强后化学平衡向气体的体积减小的方向移动,据此进行判断PCl5的体积百分数的变化.
解答:
解:把加入2molPCl5所到达的平衡,可等效为先将容器体积增大1倍到达的平衡状态,该状态与开始加入1molPCl5是完全相同的平衡状态,然后在将体积压缩恢复到原来的体积,
增大压强后平衡向体积减小的方向移动,即平衡向逆反应方向移动,
所以PCl5的分解率减小,PCl5所占的体积百分数最大,即:M<N,
故选C.
点评:
本题考查了压强对化学平衡的影响,题目难度中等,注意掌握影响化学平衡的元素,正确运用等效平衡是解本题的关键,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:
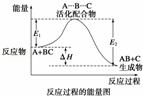
某反应过程中体系的能量变化如图所示,下列说法错误的是( )
|
| A. | 反应过程可表示为 |
|
| B. | E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 |
|
| C. | 正反应的热效应为△H=E1﹣E2<0,所以正反应为放热反应 |
|
| D. | 此图中逆反应的热效应△H=E1﹣E2<0,所以逆反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子一定能大量共存的是( )
|
| A. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl﹣、SCN﹣ |
|
| B. | 在强碱溶液中:Na+、K+、AlO2﹣、CO32﹣ |
|
| C. | 在c(H+)=10﹣13mol/L的溶液中:NH4+、Al3+、SO42﹣、NO3﹣ |
|
| D. | 在pH=0的溶液中:K+、Fe2+、Cl﹣、NO3﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
某酸HX的稀溶液和某碱YOH的稀溶液的物质的量浓度相等,两溶液混合后,溶液的PH大于7,表中判断合理的是( )
| 编号 | HX | YOH | 溶液的体积关系 |
| ① | 强酸 | 强碱 | V(HX)=V(YOH) |
| ② | 强酸 | 强碱 | V(HX)<V(YOH) |
| ③ | 强酸 | 弱碱 | V(HX)=V(YOH) |
| ④ | 弱酸 | 强碱 | V(HX)=V(YOH) |
|
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语使用不正确的是( )
|
| A. | 原子核内有18个中子的氯原子: |
|
| B. | S2﹣的结构示意图: |
|
| C. | 钒原子电子排布式:[Ar]3d34s2 |
|
| D. | NH4Br的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:
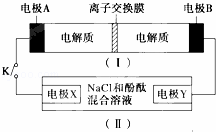
如图装置Ⅰ为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电的化学方程式为2K2S2+KI3 K2S2+3KI装置Ⅱ为电解池的示意图.当闭合开关K时,X附近溶液先变红,下列说法正确的是( )
K2S2+3KI装置Ⅱ为电解池的示意图.当闭合开关K时,X附近溶液先变红,下列说法正确的是( )
|
| A. | K+从右到左通过离子交换膜 |
|
| B. | 电极A的反应式:I3﹣+2e﹣=3I﹣ |
|
| C. | 电极X的反应式:4OH﹣﹣4e﹣═O2↑+2H2O |
|
| D. | 当电极Y有0.2mole﹣转移时,产生0.1molCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
当Mg(OH)2在水中达到溶解平衡时:Mg(OH)2(s)⇌Mg2+(aq)+2OH﹣(aq)要使Mg(OH)2进一步溶解,应向溶液中加少量的固体是( )
|
| A. | NH4Cl | B. | NaOH | C. | Na2CO3 | D. | Fe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com