
| 元素名称 | 氟 | 氧 | 溴 | 碘 | 铍 |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
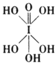 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6| 1 |
| 2 |
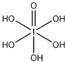 )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:HIO4>H5IO6,
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:HIO4>H5IO6,| 1 |
| 2 |


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
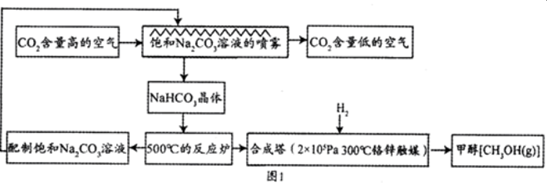
| nA |
| tA |
| n(H2) |
| n(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe与足量的Br2反应可以制得大量的FeBr3,故Fe与足量I2蒸气反应也可以制得大量的FeI3 |
| B、CO2气体通入Ca(ClO)2溶液中可以得到HClO,故SO2气体通入Ca(ClO)2溶液中也一定能得到HClO |
| C、FeCl3溶液加热蒸干后得不到FeCl3,故Fe2(SO4)3溶液加热蒸干后也得不到Fe2(SO4)3 |
| D、Cu(OH)2可溶于HNO3溶液,故Al(OH)3也可溶于HNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、灼热的镁条 |
| B、灼热的铜丝 |
| C、浓H2SO4 |
| D、一氧化氮 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com