
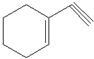
 (1)某有机化合物分子结构式如图采取sp2杂化的C原子有
(1)某有机化合物分子结构式如图采取sp2杂化的C原子有

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
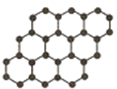 石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )
石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )| A、石墨烯与石墨互为同位素 |
| B、12g石墨烯中含有3NA个C-C键 |
| C、石墨烯是一种有机物 |
| D、石墨烯中的碳原子间以共价键结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | X | Y |
| a | SO2 | NO2 |
| b | C12 | CO2 |
| c | NH3 | CO2 |
| d | SO2 | H2S |
| ) |
| ) |
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上可用如图原理来制备高铁酸钠(Na2FeO4),下列说法正确的是( )
工业上可用如图原理来制备高铁酸钠(Na2FeO4),下列说法正确的是( )| A、该装置实现了主要的能量转化:化学能→电能 |
| B、Ni电极反应:4OH--4e-=2H2O+O2↑ |
| C、装置右侧的OH-通过隔膜移向左侧 |
| D、一段时间后,充分混合两端液体,溶液pH值会增小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com