
| 操作步骤 | 现象 |
| 步骤1:向20mL0.05mol/LAgNO3溶液中加入20mL0.05mol/LKSCN溶液,充分反应后过滤 | 出现白色沉淀 |
| 步骤2:向滤液中加少量2mol/LFe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2所得溶液中,加入少量3mol/LAgNO3溶液 | 现象a |
| 步骤4:取步骤1所得少量滤渣加入到适量的3mol/LKI溶液中 | 出现黄色沉淀 |
分析 (1)①滴定终点尽可能落在指示剂变色范围之间;醋酸为弱酸,盐酸为强酸,等浓度时醋酸的pH大;
②酸和碱都对水的电离起抑制作用,酸、碱性越强,水的电离程度越小;
③醋酸钠显示碱性,氯化钠显示中性;
④0.1mol/LNaOH溶液10mL和溶液体积为20.00mL 0.1mol/L的醋酸反应,得到的是醋酸和醋酸钠的混合物,据此确定离子浓度大小;
(2)①步骤2中溶液变红色,说明溶液中存在SCN-,该离子经过步骤1中的反应,在溶液中仍然存在,原因是AgSCN存在溶解平衡;
②银离子会和硫氰酸根离子之间反应得到AgSCN白色沉淀;
③AgSCN(s)?Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,沉淀会向着更难溶的方向转化,即Ag+与I-反应生成AgI黄色沉淀:Ag++I-═AgI↓,AgSCN的溶解平衡正向移动,反应可表示为AgSCN(s)+I-=AgI+SCN-(aq),以此书写平衡常数.
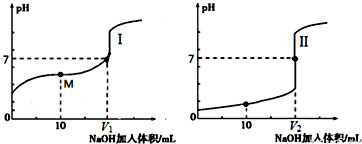
解答 解:(1)①NaOH溶液滴定醋酸溶液,滴定终点时溶液呈碱性,选择酚酞为指示剂;由图中未加NaOH时的pH可知,图Ⅰ中酸的pH大于1,图Ⅱ中酸的pH=1,说明Ⅱ为0.1mol/L的盐酸溶液,为醋酸溶液滴定过程,所以滴定醋酸的曲线是I,
故答案为:酚酞;I;
②0.1mol/LNaOH溶液氢氧根浓度是0.1mol/L,0.1mol/L的盐酸中氢离子浓度是0.1mol/L,对水的抑制作用一样,但是0.1mol/L醋酸溶液中氢离子浓度小于0.1mol/L,所以对水的电离抑制较小,即三种溶液中由水电离出的c(H+)最大的是0.1mol/L醋酸溶液;
故答案为:CH3COOH;
③醋酸和氢氧化钠反应,当恰好完全反应得到的醋酸钠显示碱性,要使得溶液显示中性,pH=7,需要醋酸稍过量,所以盐酸和氢氧化钠恰好完全反应,得到的氯化钠显示中性,所以V1<V2;
故答案为:<;
④0.1mol/LNaOH溶液10mL和溶液体积为20.00mL 0.1mol/L的醋酸反应,得到的是醋酸和醋酸钠的混合物,显示酸性,此时离子浓度大小c(CH3COO-)>c (Na+)>c (H+)>c (OH-);
故答案为:c(CH3COO-)>c (Na+)>c (H+)>c (OH-);
(2)①铁离子遇到硫氰化钾显示红色,发生的反应为:Fe3++3SCN-?Fe(SCN)3,步骤2中溶液变红色,说明溶液中存在SCN-,该离子经过步骤1中的反应,在溶液中仍然存在,原因是AgSCN存在溶解平衡AgSCN(s)?Ag+(aq)+SCN-(aq),溶液中仍有少量SCN-,
故答案为:由于存在沉淀溶解平衡AgSCN(s)?Ag+(aq)+SCN-(aq),溶液中仍有少量SCN-;
②加入硝酸银,银离子会和硫氰酸根离子之间反应得到AgSCN白色沉淀,且溶液红色变浅,
故答案为:出现白色沉淀,溶液红色变浅;
③AgSCN(s)?Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,沉淀会向着更难溶的方向转化,即Ag+与I-反应生成AgI黄色沉淀:Ag++I-═AgI↓,AgSCN的溶解平衡正向移动,反应可表示为AgSCN(s)+I-=AgI+SCN-(aq),则K=$\frac{c(SC{N}^{-})}{c({I}^{-})}$,
故答案为:$\frac{c(SC{N}^{-})}{c({I}^{-})}$.
点评 本题综合考查学生酸碱滴定、沉淀溶解平衡的移动以及溶液中离子浓度大小比较的知识,侧重于学生的分析能力和计算能力的考查,属于综合知识的考查,图象分析判断是解题关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 石油经分馏可获得含碳原子少的轻质油 | |
| B. | ①主要发生物理变化 | |
| C. | ②是石油的裂化、裂解 | |
| D. | ③属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
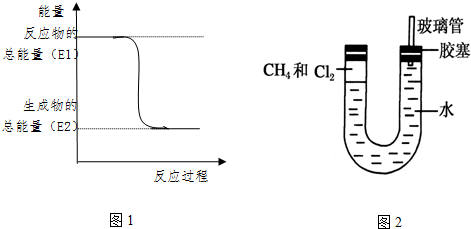
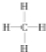 .一定量的该气体燃烧过程的能量变化如图1所示,从图中可以读出E1>E2(填“>”或“<”),该反应放出 (填“放出”或“吸收”)能量.
.一定量的该气体燃烧过程的能量变化如图1所示,从图中可以读出E1>E2(填“>”或“<”),该反应放出 (填“放出”或“吸收”)能量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2、D2、T2互为同素异形体 | |
| B. | 液氨、氨水、王水都是混合物 | |
| C. | H2O、苯酚、Fe(SCN)3都是弱电解质 | |
| D. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
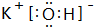 ②HClO的结构式H-O-Cl
②HClO的结构式H-O-Cl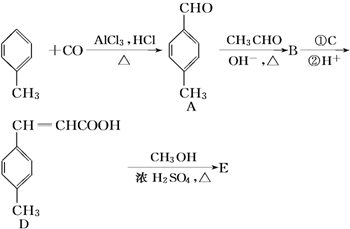
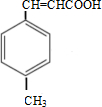 +CH3OH$→_{△}^{浓硫酸}$
+CH3OH$→_{△}^{浓硫酸}$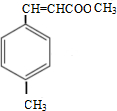 +H2O
+H2O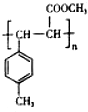 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com