
| A. | 一定条件下达到化学平衡时,N2、H2和NH3的物质的量浓度之比为1:3:2 | |
| B. | 达到化学平衡时,N2完全转化为NH3 | |
| C. | 达到化学平衡时,正反应和逆反应速率相等,且都为零 | |
| D. | 单位时间内消耗amolN2同时消耗2amolNH3,说明该反应已达到平衡状态 |
分析 该反应为可逆反应,反应物不可能完全转化,得到平衡时,正逆反应速率相等,但不为0,各物质的浓度不再发生改变,以此解答该题.
解答 解:A.向一密闭容器中充入1mol N2和3mol H2,由于转化率不能确定,则不能确定氨气与氮气和氢气的物质的量的关系,但N2、H2的物质的量浓度比为1:3,故A错误;
B.反应为可逆反应,N2不可能完全转化为NH3,故B错误;
C.达到化学平衡时,正逆反应速率相等,但不为零,故C错误;
D.单位时间内消耗a mol N2同时消耗2amol NH3,则正逆反应速率相等,说明该反应已达到平衡状态,故D正确;
故选D.
点评 本题考查较为综合,涉及可逆反应以及化学平衡状态的判断,题目难度不大,注意把握可逆反应的特点以及平衡状态的标志.


科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤⑥⑧ | B. | ①②③④⑤⑧ | C. | ②③④⑤⑧ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
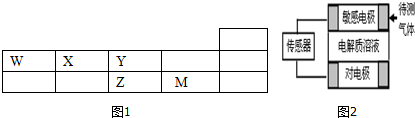
| A. | 元素Z可与元素X形成共价化合物XZ2 | |
| B. | 元素X与W形成的原子个数比为1:1的化合物有很多种 | |
| C. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| D. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取乙烯:乙醇与浓硫酸共热至140℃ | |
| B. | 除去甲烷中的乙炔:混合气体通过酸性高锰酸钾溶液,再经浓硫酸干燥 | |
| C. | 除去苯中的苯酚:加入NaOH溶液振荡,静置分层后,除去水层 | |
| D. | 检验氯乙烷中的氯元素:氯乙烷与NaOH的水溶液共热后,加入AgNO3溶液有白色沉淀生成证明含CI- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸能够使紫色石蕊试剂变红,所以乙酸是强酸 | |
| B. | 食醋除去水垢的现象证明了酸性:乙酸>碳酸 | |
| C. | 乙酸与乙醇发生的酯化反应不属于取代反应 | |
| D. | 在制备乙酸乙酯的实验中,用18O标记乙醇,在产物乙酸乙酯中检测不到18O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| X2 | 3.0 | n1 | 2.4 | n3 | n5 |
| H2 | 9.0 | 8.4 | 7.2 | n4 | n6 |
| XH3 | 0 | 0.4 | n2 | 2.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com