
| A. | H2CO3═2H++CO32- | B. | NaHSO4═Na++HSO4- | ||
| C. | NaHCO3?Na++HCO3- | D. | Ba(OH)2═Ba2++2OH- |
分析 A.多元弱酸分步电离;
B.NaHSO4是强酸强碱酸式盐,完全电离出Na+、H+、SO42-离子;
C.NaHCO3是弱酸强碱酸式盐,完全电离出Na+、HCO3-离子;
D.Ba(OH)2完全电离出钡离子和氢氧根离子.
解答 解:A.多元弱酸分步电离,H2CO3为二元弱酸,H2CO3的水溶液电离方程式:H2CO3?HCO3-+H+ 和HCO3-?CO32-+H+,故A错误;
B.NaHSO4是强酸强碱酸式盐,完全电离出Na+、H+、SO42-离子,其电离方程式为:NaHSO4=Na++H++SO42-,故B错误;
C.NaHCO3是弱酸强碱酸式盐,完全电离出Na+、HCO3-离子,电离方程式为:NaHCO3═Na++HCO3-,故C错误;
D.Ba(OH)2完全电离出钡离子和氢氧根离子,电离方程式为:Ba(OH)2═Ba2++2OH-,故D正确.
故选D.
点评 本题考查了电离方程式的书写,掌握电离方程式的书写方法并能灵活运用是正确解答此类题的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 元素 | 元素性质或原子结构信息 |
| Q | 原子核外有6种不同运动状态的电子 |
| R | 最外层电子数是次外层电子数的3倍 |
| X | 气态氢化物的水溶液呈弱碱性 |
| Y | 第三周期元素的简单离子中离子半径最小 |
| Z | 单质为银白色固体,在空气中燃烧发出黄色火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
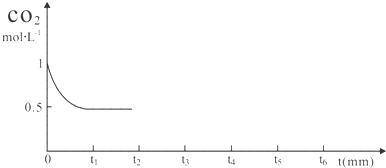
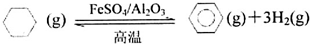
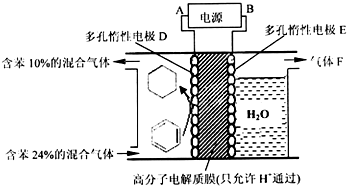
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
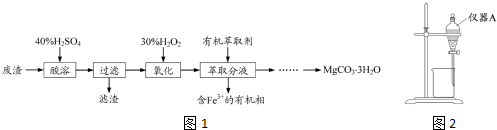
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 解释或结论 |
| A | Fe(OH )3 胶体通电后 | 阴极区红褐色加深 | Fe(OH)3胶体带正电 |
| B | Al箔插入稀HNO3中 | 无现象 | Al箔表面被稀HNO3 氧化,形成致密的氧化膜 |
| C | 将过量的过氧化钠投入 滴有酚酞试液的水中 | 最终得红色溶液 | 过氧化钠与水反应生成碱性物质 |
| D | 将镁粉和铝粉的混合物加 入过量的烧碱溶液中 | 仍有未溶解粉末 | 铝粉能与烧碱溶液反应,而镁粉不反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
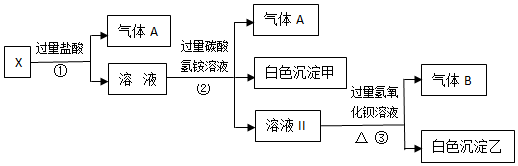
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氯储存在钢瓶中 | B. | 液溴装入试剂瓶中应加少量水液封 | ||
| C. | 固体碘保存在CCl4中 | D. | 氢氟酸盛放在塑料瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2mol | B. | 2mol | C. | 0.8mol | D. | 1.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.| 温度/℃ | 250 | 300 | 350 |
| K/L2•mol-2 | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com