
(14分) 电池的发明和应用是化学家们对人类社会的重要贡献之一。
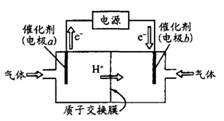
Ⅰ.每一次化学电池技术的突破,都带来了电子设备革命性的发展。最近,我国在甲醇燃料电池的相关技术上获得了新突破,原理如下图1所示。
(1)请写出从C口通入O2发生的电极反应式 。
(2)以石墨做电极电解饱和食盐水,如下图2所示。电解开始后在 的周围(填“阴极”或“阳极”)先出现红色。假设电池的理论效率为80%(电池的理论效率是指电池产生的最大电能与电池反应所释放的全部能量之比),若消耗6.4g甲醇气体,外电路通过的电子个数为 (保留两位有效数字,NA取6.02×1023)。

Ⅱ.随着电池使用范围的日益扩大,废旧电池潜在的污染已引起社会各界的广泛关注。
(1)电池生产企业排放的工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。请用离子方程式说明上述除杂的原理 。
(2)工业上为了处理含有Cr2O72-的酸性工业废水,用绿矾(FeSO4·7H2O)把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。
①氧化还原过程的离子方程式为 。
②常温下,Cr(OH)3的溶度积Ksp=1×10-32 mol4·L-4,溶液的pH至少为 ,才能使Cr3+沉淀完全。
③现用上述方法处理100m3含铬(+6价)78mg•L-1的废水,需用绿矾的质量为 kg。(写出主要计算过程)
(14分)Ⅰ.(1)O2+4e-+4H+=2H2O (2分) (2)阴极(1分);5.8×1023(2分)
Ⅱ.(1)FeS(s)+Cu2+(aq)=CuS(s) +Fe2+(aq) (2分)
(2)①Cr2O72-+6 Fe2++14H+=2Cr3++6 Fe3++7 H2O (2分) ②5(2分) ③125.1Kg (2分)
【解析】
试题分析:Ⅰ.(1)氧气在反应中得到电子,所以在正极通入。又因为存在质子交换膜,所以通入氧气的电极反应式是O2+4e-+4H+=2H2O。
(2)惰性电极电解饱和食盐水,则阳极是氯离子失去电子,阴极是氢离子得到电子生成氢气。由于氢离子放电,破坏了阴极周围水的电离平衡,所以阴极周围溶液显碱性,则阴极周围出现红色。6.4g甲醇的物质的量是6.4g÷32g/mol=0.2mol,甲醇的氧化产物是CO2,反应中失去0.2mol×(4+2)=1.2mol。又因为电池的理论效率为80%,则外电路通过的电子个数为1.2mol×80%×6.02×1023/mol=5.8×1023。
Ⅱ.(1)根据溶度积常数可知,FeS的溶度积常数大于CuS的溶度积常数,所以FeS能转化为更难溶的CuS沉淀,反应的离子方程式为FeS(s)+Cu2+(aq)=CuS(s) +Fe2+(aq)。
(2)①反应中亚铁离子的氧化产物是铁离子,Cr2O72-的还原产物是Cr3+,所以根据电子得失守恒可知,该反应的离子方程式为Cr2O72-+6 Fe2++14H+=2Cr3++6 Fe3++7H2O。
②由于溶液中Cr3+浓度小于10-5mol/L时,可以视为完全沉淀,所以根据Cr(OH)3的溶度积Ksp=1×10-32 mol4·L-4可知,要使Cr3+沉淀完全,则溶液中c(OH-)=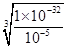 =10-9mol/L,所以pH=5。
=10-9mol/L,所以pH=5。
③根据反应的方程式可知
2Cr3+ ~ 6FeSO4·7H2O
2mol 6mol
78mg•L-1×100m3/52g• mol—1 n(FeSO4·7H2O)
解得n(FeSO4·7H2O)=450 mol
所以m(FeSO4·7H2O)=450 mol×278g• mol—1=125.1Kg
考点:考查电极反应式的书写、电极产物的判断和计算;溶解平衡以及溶度积常数和氧化还原反应的有关计算等


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
(14分)低碳生活(low-carbon life)是一种时尚的生活理念,倡导人们降碳节能、有效幵发利用CO2。
(1) 若用如图装置,以CO2和H2为原料制备甲醇,发生反应为。H2应从电解池的________(填电极名称)通入;其中b电极的电极反应方程式为________。
(2) 工业上可在6500C浮石银催化作用下用甲醇制备甲醛。当时,制备反应分两步进行,其中一步是
,则另一步是____________(写化学方程式)。
的HCHO可用于杀菌消毒,其原因是________。
(3) 最近有人利用ZrO2作为固体电解质制造出了常温下的甲醇一空气燃料电池。当原电池中有0. 5 mol甲醇消耗时,产生最大电能为360. 0 kJ。则负极消耗O2—的物质的量为________mol;若该燃料电池所产生的最大电能与甲醇常温下燃烧所释放的全部能量之比为9: 10,则CH3OH燃烧的热化学方程式为________;在O2不足时原电池会发生负极区固体电解质堵塞,导致堵塞的物质是________。
查看答案和解析>>
科目:高中化学 来源:2012届四川省成都市高三第二次诊断性检测理综试卷(带解析) 题型:填空题
(14分)低碳生活(low-carbon life)是一种时尚的生活理念,倡导人们降碳节能、有效幵发利用CO2。
(1) 若用如图装置,以CO2和H2为原料制备甲醇,发生反应为 。H2应从电解池的________ (填电极名称)通入;其中b电极的电极反应方程式为________。
。H2应从电解池的________ (填电极名称)通入;其中b电极的电极反应方程式为________。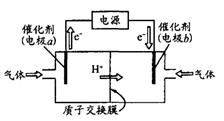
(2) 工业上可在6500C浮石银催化作用下用甲醇制备甲醛。当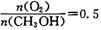 时,制备反应分两步进行,其中一步是
时,制备反应分两步进行,其中一步是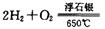
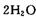 ,则另一步是____________ (写化学方程式)。
,则另一步是____________ (写化学方程式)。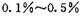 的HCHO可用于杀菌消毒,其原因是________。[来源:学_科_网]
的HCHO可用于杀菌消毒,其原因是________。[来源:学_科_网]
(3) 最近有人利用ZrO2作为固体电解质制造出了常温下的甲醇一空气燃料电池。当原电池中有0. 5 mol甲醇消耗时,产生最大电能为360. 0 kJ。则负极消耗O2—的物质的量为________mol;若该燃料电池所产生的最大电能与甲醇常温下燃烧所释放的全部能量之比为9: 10,则CH3OH燃烧的热化学方程式为________;在O2不足时原电池会发生负极区固体电解质堵塞,导致堵塞的物质是________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省成都市高三第二次诊断性检测理综试卷(解析版) 题型:填空题
(14分)低碳生活(low-carbon life)是一种时尚的生活理念,倡导人们降碳节能、有效幵发利用CO2。
(1) 若用如图装置,以CO2和H2为原料制备甲醇,发生反应为 。H2应从电解池的________
(填电极名称)通入;其中b电极的电极反应方程式为________。
。H2应从电解池的________
(填电极名称)通入;其中b电极的电极反应方程式为________。
(2) 工业上可在6500C浮石银催化作用下用甲醇制备甲醛。当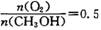 时,制备反应分两步进行,其中一步是
时,制备反应分两步进行,其中一步是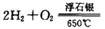
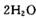 ,则另一步是____________
(写化学方程式)。
,则另一步是____________
(写化学方程式)。
 的HCHO可用于杀菌消毒,其原因是________。[来源:学_科_网]
的HCHO可用于杀菌消毒,其原因是________。[来源:学_科_网]
(3) 最近有人利用ZrO2作为固体电解质制造出了常温下的甲醇一空气燃料电池。当原电池中有0. 5 mol甲醇消耗时,产生最大电能为360. 0 kJ。则负极消耗O2—的物质的量为________mol;若该燃料电池所产生的最大电能与甲醇常温下燃烧所释放的全部能量之比为9: 10,则CH3OH燃烧的热化学方程式为________;在O2不足时原电池会发生负极区固体电解质堵塞,导致堵塞的物质是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com