
| A. | 水玻璃保存在带磨口玻璃塞的试剂瓶中 | |
| B. | 少量金属钠可保存在煤油中,大量的金属钠可保存在液体石蜡中 | |
| C. | 氢氟酸保存在磨口试剂瓶中 | |
| D. | 液溴密封盛放在无色试剂瓶中,并在液面上放一层水 |
分析 A.水玻璃能够将玻璃瓶口和瓶塞黏在一起;
B.金属钠非常活泼,能够与氧气、水反应;
C.氢氟酸能够腐蚀玻璃,不能使用玻璃瓶盛放;
D.溴水中的次溴酸见光易分解.
解答 解:A.水玻璃具有粘性,能将玻璃瓶口和瓶塞黏在一起,不能用玻璃塞,故A错误;
B.钠是活泼的金属,极易被氧化,能和水反应,所以保存在石蜡油或煤油中,故B正确;
C.氢氟酸能和玻璃的成分中的二氧化硅反应,所以盛放在塑料瓶中,故C错误;
D.溴水中的次溴酸见光易分解,应用棕色瓶,故D错误.
故选B.
点评 本题考查常见化学试剂的保存,题目难度不大,该题是基础性试题的考查,也是高考中的常见考点,该题的关键是明确常见化学试剂的性质,包括物理性质和化学性质,然后有针对性的选择即可.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:选择题
 有100mL pH=2的两种一元酸x和y,稀释过程中溶液pH与体积的关系如图所示,则下列有关说法中正确的是( )
有100mL pH=2的两种一元酸x和y,稀释过程中溶液pH与体积的关系如图所示,则下列有关说法中正确的是( )| A. | 稀释前x、y的物质的量浓度相等 | B. | 相同温度下,电离常数Ka(x)>Ka(y) | ||
| C. | 随着稀释的进行,y的电离程度减小 | D. | 稀释相同倍数后的溶液中c(H+):x>y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化产物为0.1mol | B. | 还原产物为0.1mol | ||
| C. | 氧化产物和还原产物共0.2mol | D. | 氧化产物为0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物.综合治理基污染是环境化学当前的重要研究内容之一.
二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物.综合治理基污染是环境化学当前的重要研究内容之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的氧化剂是SiO2和N2 | |
| B. | 该反应的还原产物为CO | |
| C. | 该反应中氧化剂和还原剂质量比为9:7 | |
| D. | 生成1mol Si3N4时共转移12mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
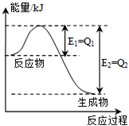 (1)下列物质中,①氯化钠溶液 ②氯化铵固体 ③铜 ④石墨 ⑤熔融NaOH ⑥稀硫酸 ⑦乙酸,属于强电解质且能导电的是⑤(填序号)
(1)下列物质中,①氯化钠溶液 ②氯化铵固体 ③铜 ④石墨 ⑤熔融NaOH ⑥稀硫酸 ⑦乙酸,属于强电解质且能导电的是⑤(填序号)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ),但是伴随副反应
),但是伴随副反应  △H1
△H1 +$\frac{5}{2}$O2(g)=2 CO2 (g)+2 H2O(g)△H=△H2-△H1.
+$\frac{5}{2}$O2(g)=2 CO2 (g)+2 H2O(g)△H=△H2-△H1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com