
 电浮选凝聚法是工业上的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示.下列说法正确( )
电浮选凝聚法是工业上的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示.下列说法正确( )| A. | 石墨电极上发生氧化反应 | |
| B. | 甲烷燃料电池中CO32-向空气一极移动 | |
| C. | 根据图示,物质A为CO2 | |
| D. | 为增强污水的导电能力,可向污水中加入适量乙醇 |
分析 左装置为电解池,右装置为原电池装置,原电池工作时,通入甲烷的一级为负极,发生氧化反应,负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,通入氧气的一极为正极,发生还原反应,正极反应为O2+2CO2+4e-=2CO32-,电解池中Fe为阳极,发生Fe-2e-=Fe2+,石墨为阴极,阴极的电极反应为:2H++2e-=H2↑,以此解答该题.
解答 解:A.石墨为阴极,阴极的电极反应为:2H++2e-=H2↑,所以石墨上发生还原反应,故A错误;
B.电池中阴离子向负极移动,则电池中CO32-向甲烷一极移动,故B错误;
C.电池是以熔融碳酸盐为电解质,通甲烷电极为负极,负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,反应生成CO2,正极反应为O2+2CO2+4e-=2CO32-,反应消耗CO2,所以物质A为CO2,故C正确;
D.加入的乙醇是非电解质,不能增强导电性,故D错误.
故选C.
点评 本题考查了燃料电池的工作原理和原电池和电解池串联的综合知识,为高频考点,侧重考查学生的分析能力,难度中等.注意把握电解池和原电池的工作原理,把握电极方程式的书写,为解答该题的关键.


科目:高中化学 来源: 题型:选择题
 短周期元素W、X、Y、Z的原子序数依次增加.甲、乙、丙、丁是由这些元素组成的二元化合物,乙为无色气体,丙为无色液体,丁为淡黄色固体.戊是元素Y的单质,是空气的主要成分,乙遇空气变红棕色,丁与丙反应有戊生成;己是元素Z的单质.上述物质的转化关系如图所示.下列说法错误的是( )
短周期元素W、X、Y、Z的原子序数依次增加.甲、乙、丙、丁是由这些元素组成的二元化合物,乙为无色气体,丙为无色液体,丁为淡黄色固体.戊是元素Y的单质,是空气的主要成分,乙遇空气变红棕色,丁与丙反应有戊生成;己是元素Z的单质.上述物质的转化关系如图所示.下列说法错误的是( )| A. | 原子半径Z>X>Y>W | B. | 丙的热稳定性不如甲 | ||
| C. | X的最高价氧化物的水化物为强酸 | D. | Z的最高价氧化物的水化物为强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
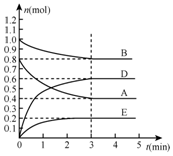 在某个容积为2L的密闭容器内,在T℃时按下图1所示发生反应:mA(g)+nB(g)?pC(g)+qE(s),△H<0(m、n、p、q为最简比例的整数).
在某个容积为2L的密闭容器内,在T℃时按下图1所示发生反应:mA(g)+nB(g)?pC(g)+qE(s),△H<0(m、n、p、q为最简比例的整数).查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 上述反应的原子利用率可达到100% | |
| B. | 在核磁共振氢谱中对羟基扁桃酸应该有8个吸收峰 | |
| C. | 对羟基扁桃酸可以发生加成反应、取代反应和缩聚反应 | |
| D. | 1 mol对羟基扁桃酸与足量NaOH溶液反应,消耗3mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | xmol | B. | (x+0.1)mol | C. | 2xmol | D. | 0.1xmol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
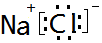 .
.| 化合物 | MgO | MgCl2 |
| 类型 | 离子化合物 | 离子化合物 |
| 熔点/℃ | 2800 | 714 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4F溶液不能存放于玻璃试剂瓶中 | |
| B. | 氮元素的非金属性强于磷,在常温下氮气活泼性也强于磷 | |
| C. | 苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应 | |
| D. | 二氧化硫和次氯酸的漂白原理不同,二氧化硫漂白时没有发生化学变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com