有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A与D按原子个数比1﹕1或2﹕l形成常温下为液态的化合物,E也能与D按原子个数比1﹕1或2﹕l形成化合物,B的外围电子数为内层电子数的两倍,B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物.请按要求回答以下问题:
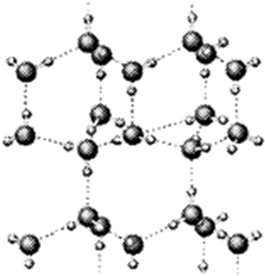
(1)如图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示
,E与D按原子个数比1﹕1形成的化合物的电子式为
.
(2)人们通常把拆开l mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.下表列出了上述部分元素形成的化学键的键能:
| 化学键 | F-D | F-F | B-B | F-B | C═D | D═D |
| 键能/kJ?mol-1 | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
①下列三种物质形成的晶体,熔点由高到低的顺序(用a、b、c表示):
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质
②F单质晶体中一个F原子与其紧邻的F原子形成的空间构型为
,
③已知加热下可发生如下转化:F(s)+D
2(g)
FD
2(s)
根据上表数据计算F单质晶体发生上述反应的反应热△H为:
.


 ,故答案为:氢键;
,故答案为:氢键; ;
;

 阅读快车系列答案
阅读快车系列答案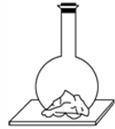 向平底烧瓶中放入氢氧化钡固体[Ba(OH)2?8H2O]和氯化铵固体,塞紧瓶塞.在瓶底和木板间滴少量水,如图所示,一会儿,就会发现瓶内固态物质变稀,有液体生成,瓶壁变冷,小木板上因少量水结冰冻结,而将烧瓶黏住,这时打开瓶塞,散发出来的气体有氨味.这是自发地发生了反应:Ba(OH)2?8H2O(s)+2NH4Cl(s)═BaCl2(s)+2NH3(g)+10H2O(l).下列结论正确的是( )
向平底烧瓶中放入氢氧化钡固体[Ba(OH)2?8H2O]和氯化铵固体,塞紧瓶塞.在瓶底和木板间滴少量水,如图所示,一会儿,就会发现瓶内固态物质变稀,有液体生成,瓶壁变冷,小木板上因少量水结冰冻结,而将烧瓶黏住,这时打开瓶塞,散发出来的气体有氨味.这是自发地发生了反应:Ba(OH)2?8H2O(s)+2NH4Cl(s)═BaCl2(s)+2NH3(g)+10H2O(l).下列结论正确的是( )