
 2Z(g)
2Z(g)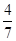 。
。 aX(g)+3Y(g)的平衡常数。
aX(g)+3Y(g)的平衡常数。科目:高中化学 来源:不详 题型:单选题
| A.2KClO3(s)=2KCl(s)+3O2(g) ΔH=-78.03kJ/mol ΔS="1110" J/(mol·K) |
| B.CO(g)=C(s,石墨)+1/2O2(g) ΔH=110.5kJ/mol ΔS="-89.36" J/(mol·K) |
| C.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH=-444.3kJ/molΔS="-280.1" J/(mol·K) |
| D.NH4HCO3(s)+CH3COOH(aq)=CO2(g)+CH3COONH4(aq)+H2O(l) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.△H<0 △S>0 | B.△H>0 △S>0 | C.△H<0 △S<0 | D.△H>0 △S<0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(s)+1/2O2(g)的△H为正值,△S为负值。若△H和△S随温度的变化忽略不计,下列说法中正确的是 ( )
C(s)+1/2O2(g)的△H为正值,△S为负值。若△H和△S随温度的变化忽略不计,下列说法中正确的是 ( )| A.低温下反应是自发进行,高温下反应是非自发进行 |
| B.任何温度下反应都是自发进行 |
| C.低温下反应是非自发进行,高温下反应是自发进行 |
| D.任何温度下反应都是非自发进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应NH3(g)+HCl(g)=NH4Cl(s)△H<0,在任何条件下均能自发进行 |
| B.铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
| C.温度一定时,水的离子积常数Kw不随外加酸(碱)浓度的改变而改变 |
| D.由于Ksp(BaSO4)小于Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.Cu(s)+2H2O(l)===2Cu(OH)2 (s)+H2(g),该反应可通过上图装置来实现 |
B.在体积可变的密闭容器中进行反应:CaCO3(s) CaO(s)+CO2(g)达到平衡后压缩体积,则v(正)、v(逆)均增大,平衡向逆反应方向移动 CaO(s)+CO2(g)达到平衡后压缩体积,则v(正)、v(逆)均增大,平衡向逆反应方向移动 |
| C.Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s) ΔH<0,由该反应可知物质能量关系一定符合:E [ZnSO4(aq)] < E [CuSO4(aq)] |
D.在密闭容器中进行反应:HI(g)  1/2H2(g)+1/2I2(s)ΔH=-26.5 kJ·mol-1,,则充入1 mol HI,达到平衡后放出26.5 kJ的热量 1/2H2(g)+1/2I2(s)ΔH=-26.5 kJ·mol-1,,则充入1 mol HI,达到平衡后放出26.5 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.是吸热反应 | B.是放热反应 |
| C.是熵减小的反应 | D.是熵增效应大于热效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com