
【题目】甲、乙、丙、丁是由![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 离子中的两种组成,可以发生如图转化,下列说法不正确的是
离子中的两种组成,可以发生如图转化,下列说法不正确的是![]()
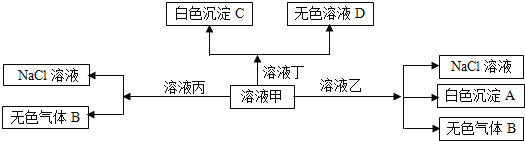
A.在甲中滴加丁可能发生反应:![]()
B.溶液丙中还可以大量共存的离子有:![]() 、
、![]() 、
、![]()
C.白色沉淀A可能溶解在溶液D中
D.甲为![]() ,乙为
,乙为![]()
【答案】B
【解析】
溶液中存在H+、Na+、Al3+、Ba2+、OH—、Cl—、HCO3—,依据离子能大量共存的原则得出甲乙丙丁中含有两种物质,即:HCl和AlCl3,因为甲溶液能和乙溶液生成沉淀,气体和氯化钠,故甲和乙中含有能双水解的离子,即Al3+和HCO3—双水解生成的气体B为二氧化碳,沉淀A为氢氧化铝,然后依据甲与丙生成气体,则甲为NaHCO3,乙为AlCl3,丙为HCl,甲与丁生成白色沉淀,则丁含有钡离子且与甲生成沉淀,则丁为Ba(OH)2。
A.甲中滴加丁,丁是过量的,那么发生的离子反应为:HCO3—+Ba 2++OH—=BaCO3↓+H2O,故A正确;
B.据分析可知,丙为HCl,含有H+,酸性条件下,NO3—具有强氧化性可氧化I—,故I—、NO3—不能共存,故B错误;
C.白色沉淀A为氢氧化铝能溶于强碱Ba(OH)2,故C 正确;
D.依据以上分析得出甲应为NaHCO3,乙为AlCl3,故D正确;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:①H2(g)+![]() O2(g)=H2O(l)ΔH=-285.8kJ/mol②H2(g)+
O2(g)=H2O(l)ΔH=-285.8kJ/mol②H2(g)+![]() O2(g)=H2O(g)ΔH=-241.8kJ/mol③C(s)+
O2(g)=H2O(g)ΔH=-241.8kJ/mol③C(s)+ ![]() O2(g)=CO(g)ΔH=―110.4 kJ/mol④C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol。回答下列各问:
O2(g)=CO(g)ΔH=―110.4 kJ/mol④C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol。回答下列各问:
(1)上述反应中属于放热反应的是_______。(填序号)
(2)H2的燃烧热为___;C的燃烧热为____。
(3)燃烧4g H2生成液态水,放出的热量为_______。
(4)根据盖斯定律可知CO的燃烧热为_____;其热化学方程式为_____。
(5)比较下列各组热化学方程式中△H的大小:
①C(s)+O2(g)=CO2(g)△H1 C(s)+![]() O2(g)=CO(g) △H2 △H1 ____△H2
O2(g)=CO(g) △H2 △H1 ____△H2
②S(s)+O2(g)=SO2(g)△H3 S(g)+O2(g)=SO2(g) △H4 △H3 __△H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、下列可用于分离和提纯物质的方法是
(1)分离NaCl溶液中的NaCl和水_________;
(2)分离乙醇和水的混合物___________;
(3)分离溴水中的溴和水_________;
(4)除去澄清石灰水中悬浮的CaCO3颗粒________;
II、掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。

(1)写出下列仪器的名称:①_____________④______________
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器__________;该分离操作的名称为__________;进行I分离操作时进水口为______(填f或g)。
(3)现需配制1000mL某溶液,其中装置II是该同学转移溶液的示意图,该同学操作的错误是_______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡状态的标志是( )
2C(g)达到平衡状态的标志是( )
A.C的生成速率与C的分解速率相等
B.A、B、C的分子数之比为1:3:2
C.单位时间生成nmolA,同时生成3nmolB
D.A、B、C的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分难溶物的颜色和常温下的Ksp如下表所示:
Cu(OH)2 | CuOH | CuCl | Cu2O | |
颜色 | 蓝色 | 黄色 | 白色 | 砖红色 |
Ksp(25 ℃) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 | — |
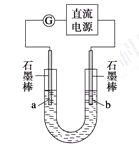
某研究性学习小组对电解食盐水进行了如下探究:
实验Ⅰ装置如图所示,接通电源后,发现a、b电极上均有气泡产生。
(1)电解过程中的总离子反应方程式为_________________________________________。
(2)为了确定电源的正、负极,下列操作一定行之有效的是_______。
A.观察两极产生气体的颜色
B.往U形管两端分别滴入数滴酚酞试液
C.用燃着的木条靠近U形管口
D.在U形管口置一张湿润的淀粉KI试纸
实验Ⅱ把上述电解装置的石墨棒换成铜棒,用直流电源进行电解,装置如图所示。

观察到的现象如下所示:
①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5 min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10 min后,最靠近a极的白色沉淀开始变成红色;
④12 min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显砖红色。
(3) a极发生的电极反应方程式为________________________________________________________。
(4) 电解5 min后,b极发生的电极反应方程式为___________________________________________。
(5)12 min后,b极附近出现的橙黄色沉淀的成分是_____,原因是___________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用NaOH溶液作![]() 捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品
捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品![]()
(1)若某次捕捉后得到![]() 的溶液,则溶液中
的溶液,则溶液中![]() :
:![]() ______
______![]() 常温下
常温下![]() 、
、![]() ,
,
(2)欲用5L![]() 溶液将
溶液将![]()
![]() 固体全都转化为
固体全都转化为![]() ,则所用的
,则所用的![]() 溶液的物质的量浓度至少为______。
溶液的物质的量浓度至少为______。![]() 已知:常温下
已知:常温下![]() 、
、![]() 忽略溶液体积的变化
忽略溶液体积的变化![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金是建造航空母舰的主体材料.
(1)航母升降机可由铝合金制造.
①铝元素在周期表中的位置为 ______ ![]() 工业用铝土矿冶炼铝的化学方程式 ______ .
工业用铝土矿冶炼铝的化学方程式 ______ .
②![]() 合金焊接前用NaOH溶液处理
合金焊接前用NaOH溶液处理![]() 膜,其化学方程式为 ______ .
膜,其化学方程式为 ______ .
(2)![]() 也是重要的铝盐,其无水
也是重要的铝盐,其无水![]() 升华
升华![]() 遇潮湿空气即产生大量白雾,实验室可用下列装置制备.
遇潮湿空气即产生大量白雾,实验室可用下列装置制备.
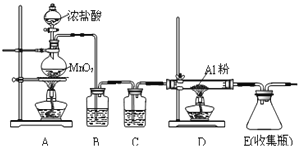
①装置在实验开始前应 ______ ,操作方法是: ______ .
②装置B中盛放饱和NaCl溶液,该装置的主要作用是 ______ ![]() 装置C中盛放 ______ .
装置C中盛放 ______ .
③装置A中发生的离子反应 ______ .
④该装置缺少尾气处理装置,尾气处理装置用的仪器是 ______ 装碱石灰.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容积为2L的密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示。
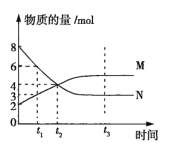
(1)该反应的化学方程式为___。
(2)比较t2、t3时正、逆反应速率的大小(用v正、v逆表示):t2时__;t3时__。
(3)若t2=2min,则反应开始至t2时,M的平均反应速率为__。
(4)下列说法可以表明该反应已达到平衡状态的是__(填序号)。
A.混合气体的密度不变
B.正、逆反应速率都等于零
C.M、N的物质的量浓度不变
D.M、N的物质的量浓度相等
(5)t3时化学反应达到平衡状态,请写出3个可以提高此时该反应化学反应速率的方法:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com