
【题目】如图所示,某同学设计一个燃料电池并探究氯碱工业原理和电解CuSO4溶液,其中乙装置中X为阳离子交换膜。
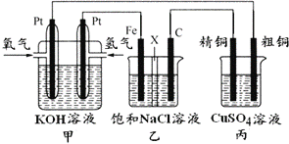
根据要求回答相关问题:
(1)通入氧气的电极为___(填“正极”或“负极”),负极的电极反应式为___。
(2)铁电极为___(填“阳极”或“阴极”),石墨电极(C)的电极反应式为___。
(3)乙装置中电解的总反应的离子方程式为___。
(4)若在标准状况下,有1.12L氧气参加反应,丙装置中阴极增重的质量为___。
【答案】正极 H2-2e-+2OH-=2H2O 阴极 2Cl--2e-=Cl2↑ 2Cl-+2H2O![]() H2↑+Cl2↑+2OH- 6.4g
H2↑+Cl2↑+2OH- 6.4g
【解析】
(1)燃料电池是将化学能转变为电能的装置,属于原电池,通入燃料的电极是负极,负极上燃料失电子发生氧化反应,据此分析解答;
(2)电解饱和氯化钠溶液时,连接原电池负极的电极是阴极,连接原电池正极的电极是阳极,阳极上氯离子放电,阴极上氢离子放电,注意如果活泼电极作阳极,则阳极上电极材料放电而不是溶液中阴离子放电;
(3)乙装置阳极为惰性电极电解饱和氯化钠溶液,据此写出电解总反应;
(4)丙装置中阴极增重的质量为析出铜的质量,串联电池中转移电子数相等,根据转移电子数相等计算丙装置中阴极析出铜的质量。
(1)燃料电池是将化学能转变为电能的装置,属于原电池,通入燃料的电极是负极,通入空气或氧气的电极是正极,所以通入氧气的电极是正极,负极上氢气失电子结合溶液中的氢氧根离子生成水,电极反应式为:H2-2e-+2OH-=2H2O,故答案为:正极,H2-2e-+2OH-=2H2O;
(2)燃料电池相当于电源,乙装置有外接电源属于电解池,铁电极连接原电池的负极,所以是阴极,则石墨电极是阳极,阳极上氯离子放电生成氯气,电极反应式为:2Cl--2e-═Cl2↑,故答案为:阴极;2Cl--2e-═Cl2↑;
(3)乙装置是阳极为惰性电极的电解饱和氯化钠溶液电解池,阳极氯离子放电生成氯气,阴极水电离出的氢离子放电生成氢气,则电解总反应离子方程式为2Cl-+2H2O ![]() 2OH-+Cl2↑+H2↑,故答案为:2Cl-+2H2O
2OH-+Cl2↑+H2↑,故答案为:2Cl-+2H2O ![]() 2OH-+Cl2↑+H2↑;
2OH-+Cl2↑+H2↑;
(4)丙装置中阴极增重的质量为析出铜的质量,根据串联电池中转移电子数相等得氧气和铜的关系式为:O2~2H2~2Cu,设生成铜的质量是y,
O2~~~2Cu
22.4L 128g
1.12L y
![]() =
=![]() ,解得:y=6.4g,故答案为:6.4g。
,解得:y=6.4g,故答案为:6.4g。


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】如图是草酸溶液中![]() 、
、![]() 三种微粒的分布分数
三种微粒的分布分数![]() 某微粒物质的量浓度与三种微粒物质的量被度和的比值
某微粒物质的量浓度与三种微粒物质的量被度和的比值![]() 与pH的关系图,下到有关说法不正确的是
与pH的关系图,下到有关说法不正确的是![]()
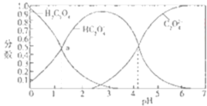
A.![]() 的溶液中
的溶液中![]()
B.![]() 溶液中:
溶液中:![]()
C.向![]() 溶液中加强酸至pH与a点对应时,溶液中
溶液中加强酸至pH与a点对应时,溶液中![]()
D.为使溶液中![]() 尽可能多一些,溶液的pH最好控制在
尽可能多一些,溶液的pH最好控制在![]() 左右
左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是
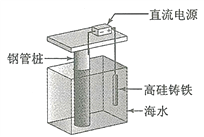
A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中![]() 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K、Ka、Kw、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是___。
![]() 它们都能反映一定条件下对应变化进行的程度
它们都能反映一定条件下对应变化进行的程度
![]() 它们的大小都随温度的升高而增大
它们的大小都随温度的升高而增大
![]() 常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)已知25℃时CH3COOH和NH3·H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为___,溶液中离子浓度大小关系为___。
(3)氯化铝溶液蒸干、灼烧后得到的固体物质是___。
(4)泡沫灭火器的反应原理(硫酸铝溶液与小苏打)___。(写离子方程式)
(5)已知在25℃时Ksp[Mg(OH)2]=3.2×10-11,Ksp[Cu(OH)2]=2.2×10-20。25℃时,向浓度均为0.02mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成沉淀___(填化学式);当两种沉淀共存时,![]() =___。
=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.己知2C+SiO2![]() Si+2CO↑,说明Si的非金属性比C强
Si+2CO↑,说明Si的非金属性比C强
B.电子层数越多,原子半径一定越大
C.单质中不可能含有离子键
D.第ⅥA族元素的氢化物中,稳定性最强的其沸点最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.25℃时NH4Cl溶液的Kw大于100℃时NaCl溶液的Kw
B.FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
C.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
D.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中,A是氯气发生器,C.D为气体净化装置,其中C中装有饱和食盐水,D中装有浓硫酸,E为装有细铜丝网的硬质玻璃管,F为干燥的广口瓶,烧杯G中装有氢氧化钠溶液。
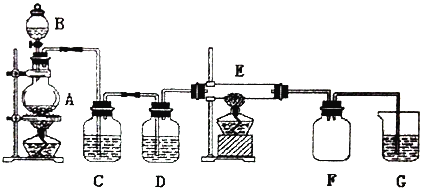
(1)C装置的作用是___,D装置的作用是___。
(2)E装置中发生的化学反应方程式是___。
(3)F装置的作用是___。
(4)G装置中所发生反应的离子方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对FeC13溶液与KI溶液反应进行探究实验,按选项ABCD顺序依次进行操作,依据现象,所得结论错误的是
操作 | 现象 | 结论 | |
A | 取2mL 0.1molL-1KI溶液于试管中,滴加3滴0.1molL-1FeCl3溶液,振荡,充分反应。将所得溶液分别置于试管①和试管②中 | 溶液呈深棕黄色 | FeCl3与KI反应,生成了I2 |
B | 向试管①中滴加2滴0.1molL-1 KSCN溶液 | 溶液显红色 | FeCl3与KI反应具有可逆性 |
C | 向试管②中加入1mLCCl4,充分振荡,静置 | 溶液分层,上层为浅棕黄色,下层为紫色 | 上层溶液为浅棕黄色,证明有Fe3+剩余 |
D | 取试管②的上层液体置于试管③中,滴加0.1molL-1 KSCN溶液 | 溶液显浅红色 | 试管③中红色比试管①中浅,是平衡移动的结果 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com