
���б�ʾ��Ӧ��ѧ��Ӧ�����ӷ���ʽ��ȷ���ǣ�������
| �� | A�� | Ư��¶���ڿ�����ʧЧ��ClO��+CO2+H2O=HClO+HCO3�� |
| �� | B�� | ��NaAlO2��Һ��ͨ�����CO2��AlO2��+CO2+2H2O=Al��OH��3��+HCO3�� |
| �� | C�� | ��Na2S2O3��Һ��ͨ������������S2O32��+2Cl2+3H2O=2SO32��+4Cl��+6H+ |
| �� | D�� | ��ǿ����Һ�д���������Fe��OH��3��Ӧ����Na2FeO4��3ClO��+Fe��OH��3=FeO42��+3Cl��+H2O+4H+ |
| ���ӷ���ʽ����д��. | |
| ר�⣺ | ���ӷ�Ӧר�⣮ |
| ������ | A��Ư���ڿ����б�������Ϊ����Ч�ɷִ������������еĶ�����̼��Ӧ�����˴����ᣬ���Ҵ�������⡢���ȷֽ⣬�Ӷ�ʹƯ��ʧЧ�� B��NaAlO2��Һͨ������Ķ�����̼������̼�����Ա���������ǿ��������������������ɫ������̼�����ƣ� C��Na2S2O3��S�Ļ��ϼ�Ϊ+2��Na2S2O3��������Ӧ���ɽ�������ȫת��ΪCl�������������ᡢ�Ȼ��ƺ��Ȼ��⣻ D����ǿ����Һ�д���������Fe��OH��3��Ӧ����Na2FeO4������ʽ���ҵ�ɲ��غ㣬�Ҳ����ɼ������ |
| ��� | �⣺A��Ca��ClO��2��Ư������Ч�ɷ֣�Ư�����ڿ�������ʧЧ��ԭ���Ƿ���Ca��ClO��2+H2O+CO2=CaCO3��+2HClO��2HClO B����NaAlO2��Һ��ͨ�����CO2����Ӧ���ɵ���̼��������ӣ����ӷ���ʽΪ��AlO2��+CO2+2H2O�TAl��OH��3��+HCO3������B��ȷ�� C�������������������Ӧ�������ᡢ�Ȼ��ƺ����ᣬ��Ӧ�Ļ�ѧ����ʽΪ��Na2S2O3+4Cl2+5H2O�T2NaCl+6HCl+2H2SO4�����ӷ���ʽΪ��S2O32��+4Cl2+5H2O=2SO42��+8Cl��+10H+����C���� D����ǿ����Һ�д���������Fe��OH��3��Ӧ����Na2FeO4�����ӷ�ӦΪ3ClO��+2Fe��OH��3+4OH��=2FeO42��+3Cl��+5H2O����D���� ��ѡB�� |
| ������ | ���⿼�������ӷ���ʽ�������жϣ���ȷ�ж����ӷ���ʽ���÷�����1����鷴Ӧ�ܷ�������2����鷴Ӧ��������Ƿ���ȷ����3���������ʲ���Ƿ���ȷ����4������Ƿ�����غ��ϵ���磺�����غ�͵���غ�ȣ�����5������Ƿ����ԭ��ѧ����ʽ��Bѡ�Ӧ���ɵ���̼���������Ϊ�״��㣬��Ŀ�Ѷ��еȣ� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����ЧӦ�����ֽ�������Һ��һ����õķ�����
��1����ͼ����ʵ�����н��������������嶡���ЧӦʵ���ʾ��ͼ����ͼ����һ�����Դ�����________________________________________________________________________��ԭ����_________ ___________________________��(�Դӷ�ɢϵ�ķ����������˵��)
��2�����������й۲쵽�����ЧӦ������Ϊһ�������п��ܹ۲쵽�������ʱ����________��������_____________________________________________________________________��
��3��ȥ���ֹ۲춡���ЧӦ�����㣬������������������ڼ���������ЧӦ�ķ����������������ķ����ǣ� _________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijͬѧ�û��յ�þ���Ͻ���ȡ����������l0.8gþ���Ͻ�����˵����ȷ���ǣ�������
| �� | A�� | ������������18mol/LH2SO4��Ӧ�����ɷų�0.6 mol H2 |
| �� | B�� | ������������2mol/LHNO3��Ӧ�����ٿɷų�0.45 mol H2 |
| �� | C�� | ������������2 mol/L H2SO4��Ӧ���ų�H2������0.45 mol��0.6 mol֮�� |
| �� | D�� | ������������2mol/LNaOH��Ӧ���ų�H2������0.45 mol��0.6 mol֮�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��Ӧ��2SO2��g��+O2��g��⇌2SO3��g����H��0��ij�¶��£���2mol SO2��1mol O2����10L�ܱ������У���Ӧ��ƽ���SO2��ƽ��ת���ʣ���������ϵ��ѹǿ��p���Ĺ�ϵ��ͼ����ʾ��������˵����ȷ���ǣ�������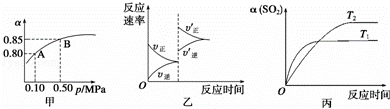
| �� | A�� | ��ͼ��֪��A��SO2��ƽ��Ũ��Ϊ0.4 mol/L |
| �� | B�� | ��ͼ��֪��B��SO2��O2��SO3��ƽ��Ũ��֮��Ϊ2��1��2 |
| �� | C�� | ��ƽ�����С�����ݻ�����Ӧ���ʱ仯ͼ�������ͼ�ұ�ʾ |
| �� | D�� | ѹǿΪ0.50 MPaʱ��ͬ�¶���SO2ת�������¶ȹ�ϵ���ͼ����T2��T1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ����Դ������������������������أ�����˵������ȷ���ǣ�������
| �� | A�� | CO2�ͷ����������ʵĴ����ŷŻ��������ЧӦ�ļӾ� |
| �� | B�� | �����ù�ҵ���������Ķ�����̼����ȫ�������� |
| �� | C�� | ������ܶೡ�ݵ����ʹ�÷Ǿ��象Ĥ���Գ������̫���ܣ����ֵ�̼���� |
| �� | D�� | ��K2FeO4����Cl2��������ˮ����ɱ���������ã��Ҳ����γ��°������ˮ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʵ�鱨���¼��ʵ��������ȷ���ǣ�������
| ʵ�� |
| ||||
| ��¼ | A | ��ɫ | ��ɫ | ������ | ��ɫ��Һ |
| B | ��ɫ | ��ɫ | ��ɫ���� | ��ɫ��Һ | |
| C | ��ɫ | ��ɫ | ��ɫ��Һ | ��ɫ���� | |
| D | ��ɫ | ��ɫ | ��ɫ��Һ | ��ɫ��Һ |
| �� | A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�Ӻ�ˮ����ȡþ������������þ����Ҫ��Դ����������ȡþ�Ĺ������漰�ļ������ʵ��ܶȻ�����������ѧ��֪ʶ�ش����м������⣺
| ���� | CaCO3 | MgCO3 | Ca��OH��2 | Mg��OH��2 |
| �ܶȻ� | 2.8��10��9 | 6.8��10��6 | 5.5��10��6 | 1.8��10��11 |
��1���ڴӺ�ˮ����ȡþʱ�������õ����ǣ���Ҫ�ɷ���̼��ƣ�������Ϊ�����ܡ�����ܡ����ܡ�����������ĥ�ɷ�ĩֱ��Ͷ�뺣ˮ�У������ǡ�������ĥ�ɷ�ĩ����CaCO3������CaCO3��MgCO3��Ҫ���ܣ����Խ���ֱ��Ͷ�뺣ˮ�в��ܲ���MgCO3�����������ֱ��Ͷ�룬Ӧ���������δ�������д����ѧ����ʽ��CaCO3\frac{\underline{\;����\;}}{\;}CaO+CO2������
��2��ijͬѧ��ʵ����������ģ����������̣���ʵ������ʯ�ң����������ռ���棬����Ϊ�����ԡ�������ԡ������ԡ����õ�Mg��OH��2���ڼ��Լ�ʱ��������Һ���뺣ˮ�У���˼����һ�£����ڵõ��Ļ����ϵ�м���������ռ���Һ������������ܡ�����ܡ����ܡ�����Mg2+ת��ΪMg��OH��2�����������ǡ�Mg2++CO32��=MgCO3 MgCO3+2OH��=Mg��OH��2+CO32�������������ӷ���ʽ��ʾ��
��3����֪��ˮ��þ����Ũ��Ϊ1.8��10��3mol/L����Ҫʹþ���Ӳ�����������Һ��pH���ӦΪ��10����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������λ�ڶ����ڵ��������ڡ���������ķǽ���Ԫ��X��Y����֪��Ԫ������������ˮ�����Ϊǿ�ᣮ������ͼת����ϵ����Ӧ���������ֲ�������ȥ�����ش��������⣺
��1����A��B��C��D��Ϊ��XԪ�صĻ������A��F��һ�������ж�ֻ����10�����ӣ���
��A���ӵĿռ乹��Ϊ�������Ρ���F���ӵĵ���ʽΪ��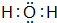 ����
����
�ڷ�Ӧ I �Ļ�ѧ����ʽΪ��4NH3+5O2 4NO+6H2O����
4NO+6H2O����
�ۻ�����NaX3�Ǻϳɡ���ơ����м�������ʣ�Ҳ��������ȫ�����е���Ҫ���ʣ�NaX3��ײ��������Na3X����һ�����嵥�ʣ���д���÷�Ӧ�Ļ�ѧ����ʽ��3NaN3=Na3N+4N2������
��X�����������γɹ⻯ѧ����ԭ��֮һ����ҵ�Ͽɲ����������⻯�ﷴӦ�����������ʶ���ȥ�����÷���ʽ��ʾ�÷�Ӧ��6NOx+4xNH3=��3+2x��N2+6xH2O����
��2����A��B��C��D��Ϊ��YԪ�صĻ��������A������Ԫ����ɣ���A��Ħ������Ϊ120g•mol��1����
�ٽ���ӦIV���õ���Һ�������ɵõ��ľ������ڡ����ӡ����壨����ӡ��������ӡ�����ԭ�ӡ���
�ڷ�Ӧ I �Ļ�ѧ����ʽΪ��4FeS2+11O2 2Fe2O3+8SO2����
2Fe2O3+8SO2����
�ۺ�YԪ�صĻ�����Na2Y�ʹ���������Һ��ǿ���Ի������ܷ�����Ӧ��������������д���÷�Ӧ�����ӷ�Ӧ����ʽ��S2��+4ClO��=SO42��+4Cl������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��B��C��D�������ʾ�Ϊ����������ɵĿ����Ի����������������ʵ����ӣ����Ӳ����ظ���ϣ��У�
| ������ | Na+��Al3+��Ba2+��NH4+ |
| ������ | Cl |
�ֱ�ȡ�������ʽ���ʵ�飬ʵ�������¢�B��Һ�ֱ���C��D��ϣ����а�ɫ�������ɢڽ�A��Һ��ε���C��Һ�У��г������ɣ������μ�A��Һʱ����������ֱ����ȫ��ʧ��A��D���ֹ��������������ɣ���������ʹʪ��ĺ�ɫʯ����Һ��������ʯī�缫���B��Һ���������ϲ���һ���д̼�����ζ������
�ش��������⣺
��1��A�����������Ӻ�C���������ӵİ뾶��С_��___��___��___�������ӷ��ţ���B��������������____��____
��2��C��Һ��__��_�ԣ�����ԡ����ԡ�������ԭ����______��____________
�������ӷ���ʽ���ͣ���D�Ļ�ѧʽ��_____��_______
��3����PtΪ�缫���1L0.1mol/LB��ˮ��Һ������·��ͨ��0.1mol����ʱ��
��Һ��pHΪ___��____�����������Һ������䣩�������ĵ缫��ӦʽΪ��___��__
��4����������������������ͨ��A��Һ����ǡ����ȫ��Ӧʱ������Һ�и�����
Ũ���ɴ�С������˳��Ϊ____________��______________
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com